Un team internazionale è stato in grado di invertire l'Alzheimer nei topi con solo 3 iniezioni di nanoparticelle, un approccio innovativo che ripristina la funzione normale del sistema vascolare, piuttosto che agire sui neuroni o su altre cellule cerebrali, come è stato fatto finora. Questo risultato è un passo promettente verso un trattamento efficace per l'Alzheimer.
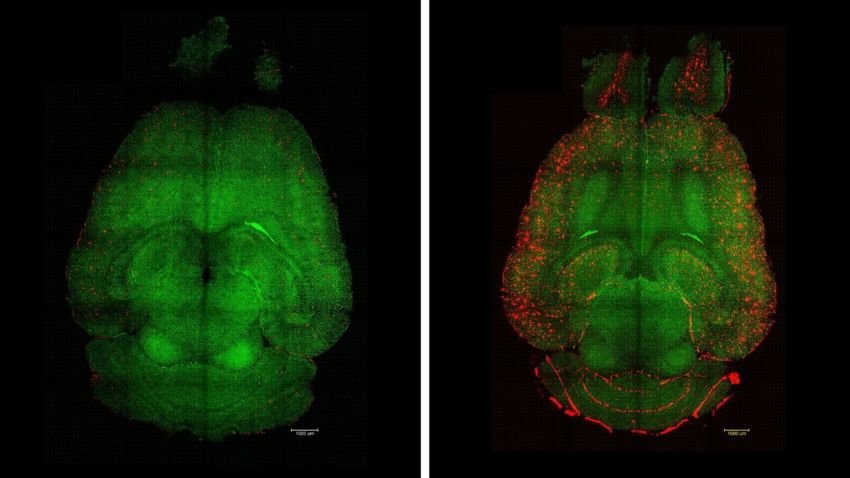 Immagini al microscopio a fluorescenza a foglio luminoso del cervello di topi 12 ore dopo essere stati trattati (a sinistra) o no (a destra) con nanoparticelle. Rosso: placche Aβ, verde: capillari della barriera emato-encefalica.
Immagini al microscopio a fluorescenza a foglio luminoso del cervello di topi 12 ore dopo essere stati trattati (a sinistra) o no (a destra) con nanoparticelle. Rosso: placche Aβ, verde: capillari della barriera emato-encefalica.
Un gruppo di ricerca co-guidato dall'Istituto di Bioingegneria della Catalogna (IBEC) e dal West China Hospital della Sichuan University (WCHSU), in collaborazione con partner nel Regno Unito, ha dimostrato una strategia nanotecnologica che inverte il morbo di Alzheimer (MA) nei topi. A differenza della nanomedicina tradizionale, che si basa sulle nanoparticelle come trasportatori di molecole terapeutiche, questo approccio impiega nanoparticelle che sono bioattive di per sé: 'farmaci supramolecolari'.
Invece di colpire direttamente i neuroni, la terapia ripristina il corretto funzionamento della barriera emato-encefalica (BEE), il guardiano vascolare che regola l’ambiente del cervello. Riparando questa interfaccia critica, nello studio pubblicato su Signal Transduction and Targeted Therapy, i ricercatori hanno ottenuto un’inversione della patologia del MA nei modelli animali.
Il cervello è l’organo più esigente del corpo, consuma il 20% dell’energia negli adulti e fino al 60% nei bambini. Questa energia arriva da un vasto apporto di sangue, assicurato da un sistema vascolare unico e denso in cui ogni neurone è nutrito da un capillare. Il nostro cervello contiene circa un miliardo di capillari, il che evidenzia il ruolo vitale del sistema vascolare cerebrale nel mantenere la salute e lottare contro le malattie. Questi risultati evidenziano il ruolo cruciale della salute vascolare, soprattutto in malattie come la demenza e il MA, dove è strettamente collegato un sistema vascolare compromesso.
La BEE è una barriera cellulare e fisiologica che separa il cervello dal flusso sanguigno per proteggerlo da pericoli esterni come agenti patogeni o tossine. Il team ha dimostrato che puntare un meccanismo specifico consente alle 'proteine di scarto' indesiderate prodotte nel cervello di passare attraverso questa barriera ed essere eliminate nel flusso sanguigno. Nel MA, la principale proteina 'di scarto' è l’amiloide-β (Aβ), il cui accumulo compromette il normale funzionamento dei neuroni.
I ricercatori hanno usato topi modello geneticamente progettati per produrre quantità maggiori di Aβ e sviluppare un declino cognitivo significativo che imita la patologia del MA. Hanno somministrato solo 3 dosi di farmaci supramolecolari e successivamente hanno monitorato regolarmente l'evoluzione della malattia. “Solo 1 ora dopo l’iniezione abbiamo osservato una riduzione del 50-60% della quantità di Aβ all’interno del cervello”, spiega Junyang Chen, primo coautore dello studio, ricercatore al West China Hospital dell’Università di Sichuan e dottorando alla University College London (UCL).
I dati più sorprendenti sono stati gli effetti terapeutici. I ricercatori hanno condotto vari esperimenti per analizzare il comportamento degli animali e misurare il declino della loro memoria nell'arco di diversi mesi, coprendo tutte le fasi della malattia. In uno degli esperimenti hanno trattato un topo di 12 mesi (equivalente ai 60 anni di un essere umano) con le nanoparticelle e ne hanno analizzato il comportamento dopo 6 mesi. Il risultato è stato impressionante: l’animale di 18 mesi (paragonabile ai 90 anni di un essere umano), aveva ripreso il comportamento di un topo sano.
"L'effetto a lungo termine deriva dal ripristino del sistema vascolare del cervello. Pensiamo che funzioni come una cascata: quando si accumulano specie tossiche come l'Aβ, la malattia progredisce. Ma una volta che il sistema vascolare è in grado di funzionare di nuovo, inizia a eliminare l'Aβ e altre molecole dannose, consentendo all'intero sistema di recuperare il suo equilibrio. Ciò che è notevole è che le nostre nanoparticelle agiscono come un farmaco e sembrano attivare un meccanismo di retroazione che riporta questo percorso di eliminazione a livelli normali”, ha affermato Giuseppe Battaglia, professore di ricerca dell'IBEC, primo ricercatore del Molecular Bionics Group e leader dello studio.
Eliminazione dell'amiloide-β dal cervello
Nel MA, uno dei problemi principali è che il sistema di eliminazione naturale del cervello per le specie tossiche come l’Aβ smette di funzionare correttamente. Normalmente, la proteina LRP1 agisce come un portiere molecolare: riconosce l’Aβ, si lega ad essa attraverso ligandi e la trasporta attraverso la BEE nel flusso sanguigno, dove può essere rimossa.
Ma questo sistema è fragile. Se la LRP1 lega troppa Aβ in modo troppo stretto, il trasporto si intasa e la proteina stessa viene degradata all’interno delle cellule della BEE, lasciando disponibili meno 'trasportatori' di LRP1. Dall'altra parte, se si lega troppo poco, il segnale è troppo debole per attivare il trasporto. In entrambi i casi, il risultato è lo stesso: l’Aβ si accumula nel cervello.
I farmaci supramolecolari sviluppati in questo lavoro agiscono come un interruttore che ripristina il sistema. Imitando i ligandi di LRP1, possono legarsi all’Aβ, attraversare la BEE e avviare il processo di rimozione delle specie tossiche dal cervello. Così facendo, aiutano a ripristinare il ruolo naturale del sistema vascolare come percorso di eliminazione dei rifiuti e a riportarlo al corretto funzionamento.
Nanoparticelle per curare l’Alzheimer
In questo studio, i ricercatori introducono nanoparticelle che agiscono come farmaci supramolecolari, agenti terapeutici a sé stanti piuttosto che trasportatori di farmaci. Progettate con un approccio di ingegneria molecolare dal basso verso l'alto, queste nanoparticelle combinano un controllo dimensionale preciso con un numero definito di ligandi superficiali, creando una piattaforma multivalente in grado di interagire con i recettori cellulari in modo altamente specifico.
Coinvolgendo il traffico dei recettori sulla membrana cellulare, aprono un modo unico e nuovo per modulare la funzione dei recettori. Questa precisione non solo consente l’efficace eliminazione dell’Aβ dal cervello, ma ripristina anche l’equilibrio del sistema vascolare che mantiene sana la funzione cerebrale. Questo paradigma terapeutico innovativo offre un percorso promettente per lo sviluppo di interventi clinici efficaci, affrontando i contributi vascolari al MA e, in definitiva, migliorando gli esiti dei pazienti.
"Il nostro studio ha dimostrato una notevole efficacia nel raggiungere una rapida eliminazione dell'Aβ, nel ripristinare una sana funzione della BEE e nel portare a una sorprendente inversione della patologia del MA", conclude Lorena Ruiz Perez, ricercatrice del gruppo di Bionica Molecolare dell'Istituto di Bioingegneria della Catalogna (IBEC) e prof.ssa assistente alla Facoltà di Fisica dell'Università di Barcellona.
Fonte: IBEC-Institute for Bioengineering of Catalonia (> English) - Traduzione di Franco Pellizzari.
Riferimenti: J Chen, [+13], G Battaglia. Multivalent modulation of endothelial LRP1 induces fast neurovascular amyloid-β clearance and cognitive function improvement in Alzheimer’s disease models. SignalTrans&TargetedTherapy, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV