L'Alzheimer è un disturbo neurodegenerativo progressivo, che si ritiene sia causato dall'accumulo di proteine nel cervello. Ma c'è sempre più evidenza che al centro della malattia ci sono diversi processi biologici, suggerendo agli scienziati un approccio diverso alle possibili terapie.
In una sessione plenaria della Conferenza Internazionale 2017 dell'Alzheimer's Association (AAIC) di Londra, Julie Williams PhD, professoressa nella Divisione di Medicina Psicologica e Neuroscienze Cliniche dell'Università di Cardiff in GB, ha sfidato le opinioni tradizionali sull'Alzheimer dicendo che "il sistema immunitario ha un ruolo significativo" nella malattia.
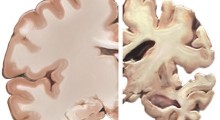
L'Alzheimer è la sesta causa di morte negli Stati Uniti, e colpisce più di 5 milioni di adulti del paese. La visione tradizionale è che le proteine si accumulano nel cervello dei pazienti, portando alla morte neuronale. I colpevoli, in base questa teoria, sono il peptide amiloide-beta e la proteina tau.
L'amiloide-beta viene prodotta quando viene tagliata una breve sezione della proteina precursore dell'amiloide (APP). Non conosciamo a cosa serve il peptide nella normale funzionalità del cervello, ma alcune evidenze indicano che ha un ruolo nei neuroni. Nell'Alzheimer, l'amiloide-beta si accumula in placche negli spazi tra i neuroni.
La tau è una proteina strutturale, importante per la funzione neuronale. Ma nell'Alzheimer, la tau non funziona correttamente e si accumula in grovigli all'interno dei neuroni. Come questo contribuisca alla morte cellulare non lo sappiamo, ma ci sono nuove evidenze che dimostrano che l'elaborazione anomala della tau può portare ad effetti tossici.
Come sfidano gli scienziati la visione tradizionale che è da incolpare l'accumulo anormale di proteine nel cervello per la neurodegenerazione dell'Alzheimer?
Sforzi congiunti per individuare nuove varianti genetiche
Fino al 2009, si conoscevano solo quattro geni associati all'Alzheimer. Le mutazioni in tre di questi (APP, presenilina 1 e presenilina 2) causano la forma ereditaria del morbo, che si sviluppa di solito in età precoce, tra i 30 e i 50 anni. È anche chiamato Alzheimer ad insorgenza precoce. Meno dell'1% dei pazienti affetti da Alzheimer hanno questa forma ereditaria della condizione, in cui si può osservare una sovrapproduzione o una piegatura anomala di amiloide-beta nel cervello. La maggioranza dei pazienti ha la forma sporadica di Alzheimer.
Malgrado che sappiamo che le mutazioni del gene apolipoproteina E (APOE) sono coinvolte nella suscettibilità e nell'età precoce, solo un sottoinsieme di pazienti presenta la variante associata alla malattia. È pertanto difficile prevedere con accuratezza il rischio di un individuo per la malattia. Per molti anni, c'è stata una grave mancanza di progressi nella ricerca che cerca di stabilire le cause dell'insorgenza.
Oggi, sappiamo che l'Alzheimer a insorgenza sporadica ha una grande componente genetica, con una ereditabilità che va dal 58 al 79 per cento. Ciò significa che devono essere coinvolte altre varianti genetiche. I progressi nella genetica e nella tecnologia hanno portato a una svolta nel 2009, quando la Prof.ssa Williams e altri ricercatori hanno identificato tre nuovi geni associati alla malattia, attraverso gli studi di associazione dell'intero genoma (GWAS).
La Prof.ssa Williams ha detto al pubblico dell'AAIC che molto presto è emerso che le scoperte future che usano questo tipo di analisi genetica sarebbero dipese da dati provenienti da un gran numero di pazienti disponibili. Per lei, l'unico modo per raggiungere questo obiettivo sarebbe stato collaborare con altri team di tutto il mondo.
All'AAIC del 2010, alle Hawaii, è nato l'International Genomics of Alzheimer's Project (IGAP), una collaborazione di quattro grandi consorzi di ricerca, guidati dalla Prof.ssa Williams e da altri scienziati di USA ed Europa. I ricercatori dell'IGAP e altri scienziati hanno ora individuato 30 geni e posizioni genetiche nel genoma umano che implicano la suscettibilità di una persona all'Alzheimer. Ma cosa possono fare gli scienziati con queste nuove informazioni genetiche?
Identificare il rischio individuale
In uno studio pubblicato sulla rivista Neurobiology of Aging nel 2017, il team della Prof.ssa William ha usato la propria conoscenza dei geni di suscettibilità per verificare con quale precisione potrebbero prevedere il rischio di Alzheimer di un individuo.
Usando dati di 17.000 pazienti di Alzheimer e 37.000 controlli, ed esaminando 87.583 mutazioni, è riuscito a identificare la condizione con un'accuratezza del 74,5%. La Prof.ssa Williams ha spiegato di essere "ora in grado di predire molto del rischio di AD ed è meglio che esaminare l'APOE. Abbiamo altri geni che sono protettivi e varianti di rischio".
Il suo team può usare questi strumenti per generare punteggi di previsione del rischio. Conoscere il livello di rischio di un individuo potrebbe aiutare a identificare chi potrebbe trarre più benefici da interventi precoci. Ma gli scienziati ancora non capiscono appieno cosa provoca la malattia. Queste nuove scoperte genetiche possono aiutare?
Dalla sensibilità al meccanismo della malattia
Invece di guardare singolarmente i geni di suscettibilità, la Prof.ssa Williams e il suo team sono interessati ai percorsi in cui sono coinvolti questi geni. L'associazione più forte che hanno saputo identificare è stato il percorso immunitario. Anche altri processi cellulari sono implicati in una certa misura, incluso il trasporto del colesterolo e la piegatura delle proteine.
"Troviamo poche prove che la produzione di amiloide-beta interessi l'AD comune", ha dichiarato la Prof.ssa Williams, aggiungendo che hanno trovato delle varianti che influenzano l'elaborazione e l'eliminazione dell'amiloide-beta. Quindi, l'accumulo di amiloide nei pazienti di Alzheimer potrebbe avere meno a che fare con l'eccesso di produzione e di più con altri processi?
La Prof.ssa Williams ha sfidato il pubblico a immaginare uno scenario in cui non c'era conoscenza storica dei geni implicati nell'elaborazione dell'amiloide coinvolta nell'Alzheimer. "L'Alzheimer è una malattia più autoinfiammatoria, che di qualsiasi altro tipo", ha dichiarato la prof.ssa Williams. "Quello che stiamo vedendo con l'immunità, accade molto presto nella malattia e forse è un evento primario che insorge accanto all'accumulazione di amiloide. Quello che dobbiamo fare è capire i meccanismi".
L'ultima scoperta del team è stata pubblicata questa settimana in Nature Genetics e sostiene questa teoria. Questo studio, eseguito dal gruppo IGAP, ha identificato due nuove varianti genetiche che conferiscono il rischio di Alzheimer. I geni (la fosfolipasi C gamma e il fattore di trascrizione ABI3 contenente il dominio B-3) sono altamente espressi nelle cellule microgliali nel cervello, che fanno parte del sistema immunitario.
La Prof.ssa Williams ha detto al pubblico che gli scienziati di tutto il mondo stanno ora studiando modelli genetici per capire meglio come il sistema immunitario è coinvolto nella neurodegenerazione dell'Alzheimer. Quello che è veramente importante è come i ricercatori stanno usando questa nuova conoscenza e la ridefinizione della condizione da usare.
Percorsi e obiettivi di farmaci
La Prof.ssa Williams ha spiegato che gli scienziati possono ora avere una visione più globale dei percorsi coinvolti nella malattia. "Potremmo trovare bersagli direttamente correlati ai geni", ha aggiunto.
Sir Simon Lovestone, psichiatra e professore di neuroscienze traslazionali dell'Università di Oxford, ha ripreso questo argomento nella sessione plenaria dell'AAIC subito dopo il discorso della Prof.ssa Williams. Il team del Prof. Lovestone ha usato set di dati provenienti da pazienti britannici e europei per esaminare le malattie neurodegenerative.
"Voglio affermare che possiamo usare questi dati, dati del mondo reale, cartelle cliniche elettroniche, per accelerare la ricerca di farmaci nella ricerca di Alzheimer", ha detto al pubblico. Per illustrare il suo approccio, ha spiegato che esaminando un gran numero di pazienti e eseguendo studi GWAS, il suo team può identificare "percorsi associati a tutte le malattie".
Ciò li ha indotti a identificare percorsi immunitari condivisi associati all'Alzheimer, alla degenerazione maculare da età e al diabete. Ciò ha permesso loro di esaminare i percorsi, piuttosto che i singoli geni, per individuare in studi di laboratorio i punti lungo quei percorsi che possono essere mirati con i farmaci.
I progressi nella tecnologia stanno armando gli scienziati di una migliore conoscenza della genetica che sottende l'Alzheimer e dei percorsi molecolari coinvolti nella patologia della malattia. Rimane da vedere come questa conoscenza potrà aiutare i pazienti, ma ci sono nuove idee che stanno di certo spingendo le frontiere della ricerca e dello sviluppo di farmaci per l'Alzheimer.
Fonte: in Medical News Today (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV