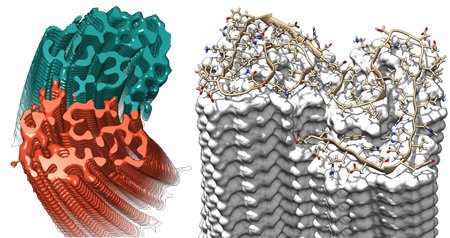
 Ricostruzione 3-D di una fibrilla amiloide proveniente da due protofilamenti (rosso / blu) calcolati dalle immagini di crio-microscopia elettronica. (Fonte: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)
Ricostruzione 3-D di una fibrilla amiloide proveniente da due protofilamenti (rosso / blu) calcolati dalle immagini di crio-microscopia elettronica. (Fonte: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)
Un team di ricercatori della Germania e dei Paesi Bassi ha determinato la struttura di una fibrilla amiloide con una risoluzione mai raggiunta finora. Le fibrille della proteina amiloide-beta (Aβ) del corpo sono il principale elemento costitutivo dell'Alzheimer e dei depositi proteici patologici caratteristici nel cervello.
La struttura tridimensionale a livello atomico chiarita dagli scienziati del Forschungszentrum Jülich, dell'Università Heinrich Heine di Düsseldorf, del Centro Biologia Sistemi Strutturali di Amburgo e dell'Università di Maastricht, mostra particolari strutturali finora ignoti che possono rispondere a molte domande sulla crescita dei depositi dannosi e anche spiegare l'effetto dei fattori di rischio genetici. I risultati sono stati pubblicati nella rivista Science.
La struttura rivela che le molte molecole singole di proteine Aβ sono sfalsate in strati sovrapposti e sono disposti nei cosiddetti protofilamenti. Due di questi protofilamenti sono appaiati, uno attorno all'altro, formando una fibrilla. Se molte di queste fibrille si aggrovigliano, si generano i depositi tipici o le placche rilevate nei tessuti cerebrali dei pazienti di Alzheimer.
 Sezione trasversale di fibrilla illustrante la disposizione sovrapposta delle proteine Aβ. (Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)"Questa è una pietra miliare sulla strada di una comprensione fondamentale delle strutture amiloidi e delle relative patologie", spiega il Prof. Dieter Willbold, direttore dell'Istituto di Biologia Fisica dell'Università Heinrich Heine di Düsseldorf e direttore dell'Istituto Sistemi Complessi (ICS-6). "La struttura della fibrilla risponde a molte domande sul meccanismo della crescita delle fibrille e identifica il ruolo di una serie di mutazioni familiari che portano all'insorgenza precoce dell'Alzheimer".
Sezione trasversale di fibrilla illustrante la disposizione sovrapposta delle proteine Aβ. (Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)"Questa è una pietra miliare sulla strada di una comprensione fondamentale delle strutture amiloidi e delle relative patologie", spiega il Prof. Dieter Willbold, direttore dell'Istituto di Biologia Fisica dell'Università Heinrich Heine di Düsseldorf e direttore dell'Istituto Sistemi Complessi (ICS-6). "La struttura della fibrilla risponde a molte domande sul meccanismo della crescita delle fibrille e identifica il ruolo di una serie di mutazioni familiari che portano all'insorgenza precoce dell'Alzheimer".
La risoluzione di 4 angstrom raggiunta dal team, corrispondente a 0,4 nanometri, è all'interno della grandezza tipica dei raggi atomici e delle lunghezze del legame atomico. A differenza del lavoro precedente, il modello mostra per la prima volta l'esatta posizione e le interazioni delle proteine. Le molecole di Aβ dei protofilamenti aggrovigliati non sono perciò allo stesso livello, ma, come una cerniera, sono sfalsati di mezzo intervallo. Inoltre, la struttura chiarisce per la prima volta la posizione e la conformazione di tutti i 42 residui di aminoacidi delle molte singole molecole proteiche dell'Aβ.
Questa struttura nuova e dettagliata fornisce una nuova base per comprendere l'effetto strutturale di una serie di varianti genetiche che aumentano il rischio di sviluppare la malattia. Esse stabilizzano le fibrille - come si può ora vedere - cambiando la conformazione iniziale della proteina in posizioni definite. Questo ad esempio spiega anche perché in natura i topi non sviluppano l'Alzheimer e perché una piccola parte della popolazione islandese sembra essere più o meno resistente alla malattia. Le loro varianti di Aβ si differenziano rispettivamente per tre residui, o uno solo, di aminoacidi che sono apparentemente importanti per la stabilità delle fibrille.
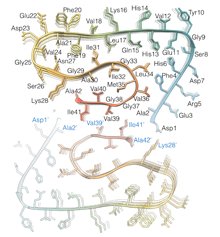 Determinazione dei 42 aminoacidi di cui è composta ciascuna molecola Aβ. (Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)Diversità metodologica al più alto livello tecnologico
Determinazione dei 42 aminoacidi di cui è composta ciascuna molecola Aβ. (Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder)Diversità metodologica al più alto livello tecnologico
A differenza delle placche tipiche della malattia scoperta da Alois Alzheimer più di 100 anni fa, la struttura della fibrilla ora scoperta non può essere osservata direttamente sotto il microscopio leggero. C'è voluto più di un anno per analizzare i dati che gli scienziati avevano ottenuto con l'impianto di crio-microscopia elettronica dell'Università di Maastricht. Inoltre, le misure ottenute usando la spettroscopia a risonanza magnetica nucleare a stato solido (NMR) e gli esperimenti di diffrazione dei raggi X hanno contribuito a completare e supportare appieno l'immagine della struttura della fibrilla e a convalidare i dati ottenuti.
"Le singole immagini in crio-microscopia elettronica sono di solito estremamente rumorose poiché le proteine sono molto sensibili alla radiazione elettronica e le immagini possono essere generate solo con un'intensità di radiazione molto bassa", spiega il Jun.-Prof. Gunnar Schröder del Forschungszentrum Jülich e della Heinrich Heine University di Düsseldorf che, con una procedura assistita da computer, ha combinato migliaia di singole immagini e ha quindi estratto i dati strutturali ad alta risoluzione.
"Questo è un passo che può essere molto complicato se il campione è eterogeneo, cioè se è costituito da fibrille formate diversamente. In passato questo era quasi sempre il caso per le fibrille amiloidi e rappresentava uno dei maggiori ostacoli per l'analisi. Ma ora abbiamo un campione abbastanza unico con fibrille molto omogenee; il 90% di loro ha la stessa forma e simmetria", spiega Schröder.
Il dottor Lothar Gremer del Forschungszentrum Jülich e dell'Università Heinrich Heine di Düsseldorf è riuscito a produrre il campione di fibrille. "Il passo cruciale è stato ritardare notevolmente la crescita delle fibrille nel campione, da poche ore a diverse settimane, per cui le singole molecole di Aβ hanno avuto tempo sufficiente per organizzarsi in fibrille omogenee in modo molto uniforme e molto ordinato", aggiunge Gremer, che ha avviato e coordinato lo studio. [...]
Sviluppo di un trattamento di Alzheimer
Oltre alla ricerca di base, l'Istituto Sistemi Complessi (ICS-6) di Jülich sta sviluppando una nuova strategia di trattamento con il proprio farmaco candidato. Si prevede di fondare quest'anno una nuova società chiamata Priavoid GmbH con la missione di proseguire questo sviluppo. Secondo il calendario attuale, si prevede che il farmaco candidato sarà testato sugli esseri umani in uno studio di fase 1 in novembre 2017.
Fonte: Forschungszentrum Juelich via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Lothar Gremer, Daniel Schölzel, Carla Schenk, Elke Reinartz, Jörg Labahn, Raimond B. G. Ravelli, Markus Tusche, Carmen Lopez-Iglesias, Wolfgang Hoyer, Henrike Heise, Dieter Willbold, Gunnar F. Schröder. Fibril structure of amyloid-ß(1-42) by cryoelectron microscopy. Science 07 Sep 2017: eaao2825. DOI: 10.1126/science.aao2825
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV