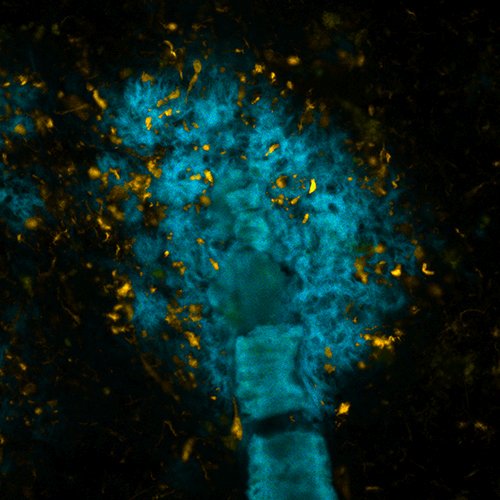
 Placca amiloide in un cervello di topo con una malattia simile all'Alzheimer, marcata da molecole sviluppate dai ricercatori della LiU. I diversi colori corrispondono a diverse strutture di beta amiloide. (Foto: Sofie Nyström)
Placca amiloide in un cervello di topo con una malattia simile all'Alzheimer, marcata da molecole sviluppate dai ricercatori della LiU. I diversi colori corrispondono a diverse strutture di beta amiloide. (Foto: Sofie Nyström)
Le immagini delle scansioni ci ricordano le galassie o le nuvole di gas colorate lontane nell'universo. Ma queste immagini non mostrano oggetti remoti nello spazio: mostrano piccole, microscopiche, lesioni nel cervello che sono state marcate con molecole traccianti sviluppate da ricercatori dell'Università di Linköping (LiU).
In diverse malattie del cervello, si formano lunghe fibre di proteine, che alla fine si ingarbugliano per formare corpi densi chiamati 'placche'. Nel Morbo di Alzheimer (MA), che causa la demenza, la placca di solito consiste in varianti difettose di due proteine: amiloide-beta e tau. Le proteine possono piegarsi in modi diversi per formare varie strutture tridimensionali diverse, e ciò può accadere anche se le molecole proteiche sono costituite dagli stessi aminoacidi, nello stesso ordine.
"La struttura e la funzione di una proteina sono di norma strettamente correlate. Una sequenza di amminoacidi dà una struttura e una funzione. Quando si formano proteine piegate erroneamente, tuttavia, hanno varie strutture diverse e crediamo che abbiano funzioni tossiche diverse. Queste proteine piegate erroneamente possono convertire altre molecole in copie di se stesse e possono essere molto difficili da abbattere. Riteniamo che alcune strutture siano più dannose di altre", afferma Per Hammarström, professore di chimica delle proteine del Dipartimento di Fisica, Chimica e Biologia dell'università.
Le molecole traccianti sviluppate dal gruppo di ricerca di Linköping sono state usate ora per la prima volta nelle indagini sul tessuto cerebrale umano. I risultati della collaborazione internazionale, che è stata guidata da ricercatori dell'Università di Tubinga in Germania, sono stati pubblicati sulla prestigiosa rivista scientifica PNAS. I ricercatori hanno studiato il tessuto cerebrale di 40 persone che sono morte con diverse varianti di MA. I sintomi della malattia differiscono da un individuo all'altro e i ricercatori volevano indagare se la grande variabilità è associata a diverse forme di piegamento errato.
Le molecole che sono attualmente usate per rivelare le placche di amiloide nel cervello marcano l'intero aggregato amiloide e possono dirci se la placca amiloide è presente o meno. Le molecole sviluppate a Linköping sono più sensibili rispetto ai metodi di colorazione tradizionali e possono fornire informazioni sulla presenza dei diversi tipi di aggregati in cui la proteina si piega in strutture diverse. I ricercatori hanno studiato le proteine piegate erroneamente nel nucleo della placca.
"Abbiamo scoperto che differiscono molto. Un individuo non ha una sola variante di amiloide-beta piegata in modo errato: ci sono molti tipi diversi", dice Per Hammarström. Non è ancora chiaro quale sia il significato delle differenze tra le varianti di piegatura. Saranno necessarie ulteriori ricerche per determinare se le differenze nella struttura sono associate ad altre proprietà della placca e al decorso della malattia nel paziente.
Molecole-camaleonte che cambiano colore
Le molecole traccianti sviluppate all'Università di Linköping possono emettere luce quando sono illuminate da una luce di diversa lunghezza d'onda. Diciamo che sono 'fluorescenti'. Ciò che rende queste molecole uniche, tuttavia, è che hanno una dorsale flessibile che si adatta alla struttura della proteina a cui sono legate. Quando la molecola si ritorce, cambia il colore della fluorescenza emessa.
Ciò significa che lo stesso tipo di molecola emetterà luce di diversi colori quando è legata a diverse strutture di amiloide-beta, allo stesso modo in cui un camaleonte adatta il suo colore all'ambiente circostante. Questo studio è il primo in cui i ricercatori hanno usato una combinazione di due molecole traccianti simultaneamente, in campioni provenienti da pazienti.
"Le due molecole si legano con diversi punti di forza a diversi tipi di aggregati amiloidi. Una di queste emette luce blu e l'altra rossa, quindi è facile vedere la differenza al microscopio", afferma Sofie Nyström, ricercatrice del Dipartimento di Fisica, Chimica e Biologia. È possibile vedere visivamente i diversi colori, ma i ricercatori hanno effettuato un'analisi dettagliata misurando a diverse lunghezze d'onda l'intensità della fluorescenza di un campione. I ricercatori possono calcolare la quantità di ciascun colore presente e in questo modo confrontare i campioni.
Nella pratica clinica, se si sospetta l'MA, la presenza di placche nel cervello può essere studiata mediante tomografia a emissione di positroni (PET). "Per un paziente nello studio, l'esame PET non ha rivelato alcun amiloide-beta, mentre abbiamo scoperto una grande quantità dell'aggregato marcandolo con le nostre molecole. Questo dimostra perché c'è una necessità pressante di ulteriori strumenti diagnostici", afferma Peter Nilsson, professore di chimica organica del Dipartimento di Fisica, Chimica e Biologia.
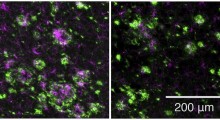
 Tessuto cerebrale con patologia di Alzheimer, colorato con una delle nuove molecole tau-specifiche (giallo-arancione) e una delle molecole precedentemente sviluppate dal gruppo LiU (blu). L'immagine è stata scattata con un microscopio a fluorescenza. (Foto: Peter R Nilsson)
Tessuto cerebrale con patologia di Alzheimer, colorato con una delle nuove molecole tau-specifiche (giallo-arancione) e una delle molecole precedentemente sviluppate dal gruppo LiU (blu). L'immagine è stata scattata con un microscopio a fluorescenza. (Foto: Peter R Nilsson)
Diagnosi più accurata della malattia del cervello
I ricercatori della LiU stanno ora sviluppando le molecole traccianti per renderle utilizzabili in una fotocamera PET. Se ci riescono, ciò migliorerebbe l'accuratezza degli esami PET e fornirebbe maggiori informazioni sulle proteine piegate erroneamente in un particolare paziente.
Sono necessarie sostanze usabili nelle indagini PET, capaci di rilevare non solo la placca nel cervello, ma anche distinguere tra amiloide-beta e tau. Ciò migliorerebbe la diagnosi della malattia del cervello. Questo perché i depositi della proteina tau sono presenti non solo nell'MA, ma anche in un gruppo di condizioni meno comuni conosciute come 'patologie tau' o taupatie.
Una di queste patologie tau è l'encefalopatia traumatica cronica (CTE), che può insorgere in individui che hanno ricevuto colpi alla testa in ripetute occasioni, come può accadere negli sport di contatto come il pugilato, l'hockey su ghiaccio e il football americano. L'unico modo attualmente disponibile per fare questa diagnosi è l'autopsia.
Peter Nilsson e i suoi colleghi sperano che sia possibile a lungo termine usare le loro molecole traccianti per rilevare i depositi tau attraverso una telecamera PET in clinica. Questo è il motivo per cui hanno sviluppato una variante delle molecole-camaleonte che può legarsi alla placca tau e segnalare la sua presenza.
Questo studio è stato pubblicato su Chemistry-A European Journal. I ricercatori hanno iniziato con una molecola tracciante che riconosce solo gli aggregati amiloide-beta, e quindi l'hanno adattata in modo che diventasse più simile alle molecole che si legano alla tau, sviluppata da altri ricercatori.
"Vediamo che cambiamenti estremamente piccoli, spostando solo un paio di atomi, possono indurre la molecola tracciante a legarsi preferenzialmente a un altro tipo di aggregato. Apportando modifiche molto piccole, possiamo personalizzare le molecole per riconoscere diversi aggregati, in base a quali proteine sono presenti", afferma Peter Nilsson.
Essi sperano che sarà possibile scoprire la malattia prima di oggi. Nel caso del'MA, sappiamo che la placca inizia a formarsi fino a 15-20 anni prima che compaiano i primi sintomi, come la perdita di memoria e le difficoltà del linguaggio. "Questo apre la possibilità di sviluppare un metodo diagnostico più avanzato in cui è possibile distinguere tra amiloide-beta e tau. Potremmo quindi indagare su quali moduli si aggregano prima e come interagiscono", afferma Peter Nilsson.
Con metodi migliori per studiare i singoli depositi di placca, sarebbe anche possibile determinare se diverse forme di trattamento aiutano contro un tipo ma non l'altro, e sarebbe possibile, negli studi clinici, valutare continuamente l'efficacia dei candidati farmaci nei pazienti viventi.
I ricercatori hanno brevettato le molecole traccianti la tau in collaborazione con un'azienda.
Fonte: Linköping University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti:
- Jay Rasmussen, Jasmin Mahler, Natalie Beschorner, Stephan Kaeser, Lisa Häsler, Frank Baumann, Sofie Nyström, Erik Portelius, Kaj Blennow, Tammaryn Lashley, Nick Fox, Diego Sepulveda-Falla, Markus Glatzel, Adrian L. Oblak, Bernardino Ghetti, Peter R. Nilsson, Per Hammarström, Matthias Staufenbiel, Lary Walker and Mathias Jucker, Amyloid polymorphisms constitute distinct clouds of conformational variants in different etiological subtypes of Alzheimer’s disease, PNAS (2017), published online 20Nov2017, doi: 10.1073/pnas.1713215114
- Hamid Shirani, Hanna Appelqvist, Marcus Bäck, Therése Klingstedt, Nigel J. Cairns, Peter R. Nilsson, Synthesis of Thiophene-Based Optical Ligands That Selectively Detect Tau Pathology in Alzheimer's Disease, Chemistry (2017), published online 8Nov2017, doi: 10.1002/chem.201703846
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV