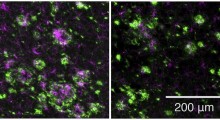
![]() Una sonda a base di rutenio in grado di monitorare la formazione degli aggregati di peptide amiloide-beta solubile implicati nell'insorgenza dell'Alzheimer. Foto di Jeff FitlowRicercatori della Rice University hanno trovato un modo per monitorare la formazione di aggregati del peptide amiloide-beta solubile implicati nell'insorgenza del morbo di Alzheimer (MA).
Una sonda a base di rutenio in grado di monitorare la formazione degli aggregati di peptide amiloide-beta solubile implicati nell'insorgenza dell'Alzheimer. Foto di Jeff FitlowRicercatori della Rice University hanno trovato un modo per monitorare la formazione di aggregati del peptide amiloide-beta solubile implicati nell'insorgenza del morbo di Alzheimer (MA).
Il laboratorio di Angelo Martí alla Rice riferisce lo sviluppo di un complesso fluorescente a base di rutenio che si lega al peptidi solubili e oligomerici di amiloide-beta. Come i peptidi si uniscono per formare le grandi biomolecole detti oligomeri, gli additivi fluorescenti si legano e li marcano.
Ciò consentirà ai ricercatori di monitorare facilmente i progressi ed i movimenti degli aggregati, man mano che crescono nel corso del tempo. I dettagli del lavoro sono pubblicati sul Journal of American Chemical Society.
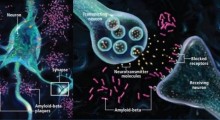
Le placche amiloidi sono da tempo sospettate di essere la causa principale del MA, ma studi recenti suggeriscono che gli oligomeri - molecole fluttuanti con unità ripetute del peptide - fanno molti più danni.
“C'è una visione nel campo che gli oligomeri solubili sono la causa principale della degenerazione neuronale, perché questi oligomeri sono tossici per i neuroni”, ha detto Martí, professore associato di chimica, bioingegneria, scienza dei materiali e nanoingegneria. “Questi oligomeri sono sicuramente associati con la patologia del MA, così c'è la necessità di strumenti che ci aiutano a studiarli”.
Ha detto che gli oligomeri sono “praticamente invisibili” ai coloranti Thioflavin T usati di solito per etichettare le fibrille amiloidi in studi di laboratorio. I complessi di rutenio risolvono il problema. I complessi sfruttano l'anisotropia di fluorescenza, in cui la risposta fluorescente è polarizzata, brillando di più in alcune direzioni rispetto ad altre.
“E 'una tecnica molto antica collegata alla rotazione delle molecole”, ha detto Martí. “Quando la molecola è in soluzione, si muove ed è in costante rotazione. Quando è molto piccola, ruota molto veloce e l'anisotropia è quasi a zero. Ma quando la stessa sonda si lega ad una grande macromolecola, ruota più lentamente. È così che capiamo di avere oligomeri, e quindi siamo in grado di monitorare la loro crescita e propagazione”.
Le prove di laboratorio hanno dimostrato che gli oligomeri si formano in soluzione a diverse temperature su più ore. Martí ha osservato che le soluzioni fredde rallentano il processo, ma alla temperatura corporea, gli oligomeri si formano “molto velocemente e in grandi quantità. La velocità con cui si formano a temperature fisiologiche è notevole”.
Il laboratorio della Rice ha usato le sue sonde anche per vedere in tempo reale come sono colpite le cellule di neuroblastoma quando ricevono iniezioni di peptidi di amiloide-beta. Hanno rilevato che solo il 60% delle cellule iniettate con oligomeri mantenevano la stessa vitalità, mentre quelle trattate con fibrille amiloidi e monomeri si agitavano circa l'80% in più, suggerendo che gli oligomeri sono realmente tossici, secondo Martí.
Per ora, ha detto, le sonde di rutenio sono pensate solo per il laboratorio. “Sarà difficile usarle nel cervello, perché c'è troppa dispersione di luce”, ha detto Martí. “Sono fatte per trarre vantaggio dalla luce polarizzata, e la dispersione la rallenterebbe. Ma come strumento di laboratorio, permetteranno ai ricercatori di tutto il mondo di testare gli effetti di altre molecole sul tasso di formazione di oligomeri, e questo è un fatto importante. Possono vedere rapidamente se un farmaco ritarda o interrompe la formazione di oligomeri”.
Fonte: Rice University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Bo Jiang, Amir Aliyan, Nathan P. Cook, Andrea Augustine, Ghibom Bhak, Rodrigo Maldonado, Ashleigh D. Smith McWilliams, Erick M. Flores, Nicolas Mendez, Mohammad Shahnawaz, Fernando J. Godoy, Javier Montenegro, Ines Moreno-Gonzalez, Angel A. Martì. Monitoring the Formation of Amyloid Oligomers Using Photoluminescence Anisotropy. Journal of the American Chemical Society, 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV