Il morbo di Alzheimer (MA) è la forma più comune di demenza negli anziani, che è sempre più importante per il carico di malattie nelle società che invecchiano, come Singapore. Nonostante questo, e la miriade di investimenti fatti nella ricerca sulla malattia, non esiste attualmente alcun trattamento efficace e un farmaco funzionante è ancora da scoprire.
Ricercatori guidati dalla Duke-NUS, in collaborazione con la Monash University, hanno ora pubblicato uno studio esauriente e dettagliato sui cambiamenti di espressione genica in tipi specifici di cellule del cervello umano che sono associati con la progressione del MA.
Sfruttando le tecnologie più recenti di sequenziamento a cella singola, i risultati producono informazioni che possono aiutare nella ricerca di potenziali bersagli genici 'trascinabili/maneggiabili' per lo sviluppo di farmaci.
“Ci sono poche informazioni sul modo in cui tipi singoli di cellule nel cervello contribuiscono al MA”, ha detto l'assistente professore Owen Rackham, della Duke-NUS, coautore senior dello studio. “Anche se vari geni sono stati implicati nel MA, non sappiamo quali tipi di cellule ospitano queste differenze di espressione genica”.
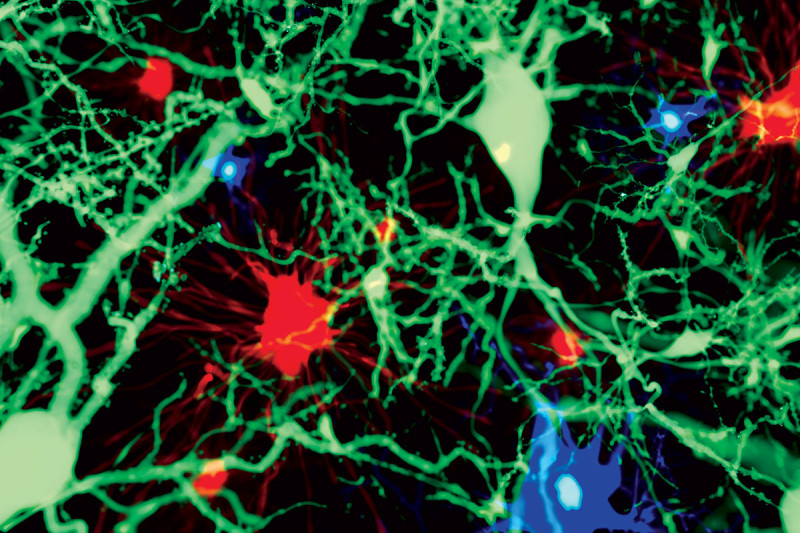
Concentrandosi sulla necessità di studiare tipi di cellule diverse dai neuroni, il tipo più diffuso nel cervello, i ricercatori hanno applicato una innovativa tecnologia di sequenziamento dell'RNA a singolo nucleo, chiamata DroNCSeq, alle cellule della corteccia entorinale del cervello, campionate da cervelli sia con MA sia sani, producendo un totale di oltre 13.000 nuclei di alta qualità che hanno potuto analizzare per trovare le differenze di espressione genica.
La corteccia entorinale e l'ippocampo sono le regioni del cervello che, secondo gli scienziati, sono coinvolte nell'elaborazione e nella memorizzazione dei ricordi, nella percezione del tempo e nella predizione del futuro.
Il professore associato Enrico Petretto, coautore senior dello studio, ha spiegato:
“La nostra ricerca ha cercato di esplorare se la risposta al trattamento del MA sta nella comprensione del modo in cui sono colpite le cellule non neuronali durante la malattia. Con la DroNCSeq siamo riusciti a studiare le differenze di espressione genica a risoluzione di singola cellula, che è la chiave per capire come i geni identificati in specifiche sotto-popolazioni cellulari dagli studi di associazione sull'intero genoma sono associati con il MA”.
Lo studio ha individuato nuove sotto-popolazioni di cellule presenti solo nel cervello dei pazienti di MA nonché le reti comuni e distinte di geni e di funzioni che sono regolate insieme in diversi tipi di cellule. Questi risultati ci danno informazioni sul controllo coordinato dei geni di rischio di MA e sul loro contributo specifico per tipo di cellula alla predisposizione alla malattia, e in ultima analisi può aiutare gli scienziati a identificare potenziali obiettivi genetici per lo sviluppo di farmaci di MA.
Per facilitare l'accesso a queste informazioni da parte di altri ricercatori, il team di ricerca ha pubblicato uno strumento interattivo online per visualizzare e analizzare il loro set di dati, fornendo una risorsa unica agli studi futuri che cercano di capire le differenze cellulari e definire le modifiche funzionali a livello di singola cellula nel cervello umano con MA.
Il professor Patrick Casey, Vice Decano Senior della Duke-NUS, ha commentato:
“Il MA colpisce non solo il paziente, ma anche i suoi caregiver. Si tratta di una malattia globale con un impatto biologico, sociale, psicologico ed economico che potrà solo aumentare di importanza con il crescente invecchiamento della popolazione in tutto il mondo. Questo studio sottolinea l'importanza del ruolo che l'innovazione tecnologica e la scienza dei dati può avere non solo per aiutarci a comprendere meglio la malattia, ma anche per identificare potenziali bersagli farmacologici”.
Il team di ricerca sta andando avanti con ulteriori ricerche sui geni potenziali identificati.
Fonte: Duke-NUS / National University of Singapore (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Alexandra Grubman, Gabriel Chew, John F. Ouyang, Guizhi Sun, Xin Yi Choo, Catriona McLean, Rebecca K. Simmons, Sam Buckberry, Dulce B. Vargas-Landin, Daniel Poppe, Jahnvi Pflueger, Ryan Lister, Owen J. L. Rackham, Enrico Petretto & Jose M. Polo. A single-cell atlas of entorhinal cortex from individuals with Alzheimer’s disease reveals cell type-specific gene expression regulation. Nature Neuroscience, 25 Nov 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV