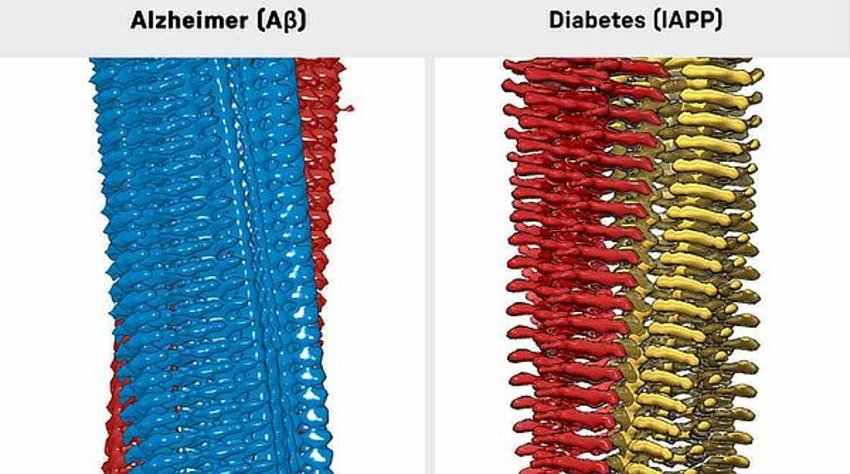
 Ricostruzione in 3D di fibrille amiloide-beta (a sinistra) e IAPP (a destra).
Ricostruzione in 3D di fibrille amiloide-beta (a sinistra) e IAPP (a destra).
Gli ammassi patologici di proteine sono caratteristici di una serie di malattie, come il morbo di Alzheimer (MA), il Parkinson, e il diabete di tipo 2.
Scienziati del Forschungszentrum Jülich, della Heinrich Heine University Düsseldorf (HHU), e della Maastricht University hanno ora usato la microscopia crioelettronica per ottenere la prima immagine nitida della disposizione individuale delle molecole nelle stringhe di proteine, che costituiscono i depositi tipici del diabete.
La struttura delle fibrille è molto simile a quella di fibrille del MA. Questi risultati sono coerenti con altri punti in comune tra le malattie, che i ricercatori hanno scoperto in questi ultimi anni.
Circa 120 anni fa, il medico statunitense Eugene Lindsay Opie ha scoperto depositi insoliti di proteine nel pancreas di pazienti con diabete di tipo 2, che erano simili a quelli che si trovano nel cervello in molte malattie neurodegenerative. Il diabete di tipo 2 è una delle malattie più diffuse, chiamata in precedenza diabete a insorgenza adulta.
I depositi, chiamati 'amiloide dell'isolotto', comprendono piccoli fili di proteine (fibrille) che, nel caso del diabete, consistono dell'ormone peptidico IAPP. Nel pancreas, contribuiscono alla morte e alla disfunzione delle cellule beta che sono responsabili della produzione di insulina. L'ormone ha un ruolo importante nel ridurre i livelli di zucchero nel sangue.
“Queste fibrille amiloidi sono studiate intensamente da molti anni. Per molto tempo, tuttavia, era possibile attingere alle strutture solo a risoluzione molto bassa“, spiega Gunnar Schröder del Forschungszentrum Jülich e della Heinrich Heine University Düsseldorf. Nel 2017, in collaborazione con partner e colleghi, Schröder ha presentato uno dei primi modelli 3D di tale fibrilla, a livello atomico: in questo caso una fibrilla di MA che comprende un peptide amiloide-beta (Aβ).
“Siamo riusciti a realizzare per la prima volta una ricostruzione 3D di una fibrilla IAPP tipica del diabete con risoluzione paragonabile”, afferma Schröder. La risoluzione ottenuta di 4 angstrom, corrispondenti a 0,4 nanometri, è nell'ambito di grandezza dei raggi atomici e delle lunghezze dei legami atomici.
Oltre ad altri dettagli, in questo modo diventa visibile per la prima volta la disposizione precisa delle molecole nelle fibrille. Il modello mostra che singole molecole IAPP vengono impilate una sopra l'altra per formare fibre con una sezione trasversale a forma di S. La struttura è simile a quella delle fibrille di Aβ sagomate a S tipiche del MA.
“Questa somiglianza è interessante. C'è una correlazione epidemiologica tra il MA e il diabete: i malati di MA hanno un rischio maggiore di contrarre diabete e viceversa “, spiega Wolfgang Hoyer, che fa ricerca sia alla Università Heinrich Heine di Düsseldorf che al Forschungszentrum Jülich.
Ci sono anche altre correlazioni. Ad esempio, gli scienziati hanno già rilevato piccole impurità di peptidi IAPP 'stranieri' tipici del diabete nei depositi amiloidi dei malati di MA. Inoltre, quando si aggiunge uno dei tipi di fibrille, c'è una maggiore crescita dei depositi dell'altro tipo, come i ricercatori hanno scoperto nei test sui topi.
Il nuovo modello di fibrille ad alta risoluzione costituisce ora una piattaforma per acquisire una migliore comprensione della formazione delle fibrille nel caso di diabete e per lo sviluppo di farmaci in grado di affrontare direttamente la causa della malattia.
“Possiamo ora sviluppare degli inibitori, per esempio, per sopprimere in modo mirato la formazione delle fibrille”, spiega Hoyer, che sta cercando da diversi anni delle proteine leganti in questo campo. Tali proteine impediscono alle singole molecole di formare amiloidi e possono quindi ritardare, o addirittura arrestare, lo scoppio del diabete, del MA e del Parkinson.
Un altro approccio è lo sviluppo di sostituti del peptide IAPP che non sono inclini a formare fibrille. Tra le funzioni che l'IAPP assume c'è la soppressione di un ormone dell'appetito nel corpo. I sostituti non sono interessanti quindi solo per il trattamento del diabete di tipo 2, ma anche per trattare altre malattie come il diabete di tipo 1 e l'obesità patologica.
Fonte: Heinrich-Heine-Universität Düsseldorf (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Christine Röder, Tatsiana Kupreichyk, Lothar Gremer, Luisa U. Schäfer, Karunakar R. Pothula, Raimond B. G. Ravelli, Dieter Willbold, Wolfgang Hoyer & Gunnar F. Schröder. Cryo-EM structure of islet amyloid polypeptide fibrils reveals similarities with amyloid-β fibrils. Nature Structural & Molecular Biology, 15 June 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV