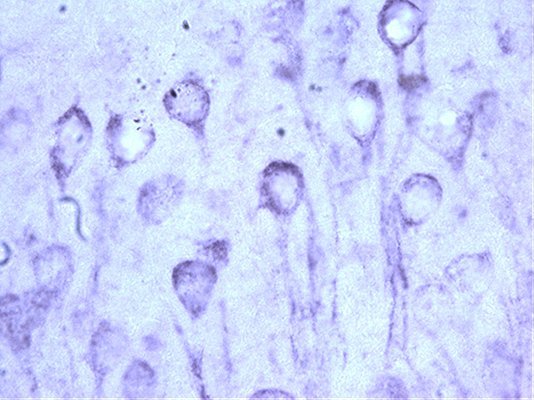
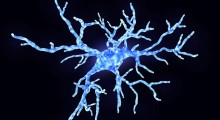
 Patologia Tau che ricorda quella del cervello con Alzheimer. (Fonte: Laura Blair laboratory, USF Health)
Patologia Tau che ricorda quella del cervello con Alzheimer. (Fonte: Laura Blair laboratory, USF Health)
Lo squilibrio di una proteina chaperone (cicerone, guida) può avere un ruolo significativo nell'avvio dell'accumulo tossico di tau nel cervello invecchiato, un primo passo nello sviluppo del morbo di Alzheimer (MA) e dei relativi disturbi neurodegenerativi chiamati taupatie, secondo un nuovo studio preclinico eseguito alla Università della Florida del Sud.
Nell'uomo, il ripiegamento errato della proteina tau conduce al suo accumulo tossico all'interno delle cellule cerebrali, porta alla formazione di questi aggregati tau in grovigli neurofibrillari, alla morte dei neuroni, e infine ai sintomi di declino cognitivo come perdita di memoria e calo delle competenze di pensiero.
In questo studio, i ricercatori della USF hanno usato topi che non erano geneticamente modificati (topi di tipo selvaggio) per esaminare gli effetti dell'AHA1 e della FKBP52, due proteine con-chaperoni della proteina da shock termico HSP90, nel cervello invecchiato. Hanno modellato lo squilibrio molecolare sovra-esprimendo la produzione di AHA1 e FKBP52 in questi topi vecchi di tipo selvaggio. I risultati, evidenziati qui sotto, sono stati pubblicati su Acta Neuropathologica Communications.
L'HSP90 è una proteina chaperone abbondante nei neuroni e in altre cellule nel cervello. Normalmente, le proteine con-chaperoni aiutano le proteine chaperoni a monitorare e sostenere l'equilibrio (omeostasi) delle proteine fondamentali per la salute delle cellule.
"La rete di proteine chaperoni è la difesa naturale della tua cellula per mantenere l'omeostasi per tutta la vita, e questo studio sottolinea l'importanza di proteggere quell'equilibrio nel cervello invecchiato", ha affermato l'autrice senior Laura Blair PhD, assistente professoressa di medicina molecolare alla USF. "Siamo entusiasti di usare questo nuovo modello di taupatia per trovare i modi per ripristinare l'equilibrio delle proteine, e ritardare o fermare la progressione del MA e delle altre neurodegenerazioni".
Tra le loro numerose funzioni di controllo di qualità, le reti di proteine chaperoni garantiscono che le proteine siano piegate in conformità alle forme 3D corrette, trasportate con precisione dove servono per fare il loro lavoro e spinte verso la degradazione se sono modificate anormalmente o non più utili. Le proteine di shock termico come l'HSP90, innescate quando una cellula è sotto stress, hanno un ruolo di 'triage' (smistamento) particolarmente importante per correggere l'errato ripiegamento della proteina e impedirne l'aggregazione.
"Ma nel cervello invecchiato, l'equilibrio delle proteine chaperoni sposta e crea un sistema che non funziona in modo efficiente come dovrebbe essere di norma. Grandi numeri di molecole chaperoni diminuiscono in espressione e un numero più piccolo ma significativo aumenta l'espressione", ha detto la dott.ssa Blair.
L'aumento dell'età è il più grande fattore di rischio conosciuto per il MA. Quindi, il team della USF ha studiato se un aumento dei livelli di FKBP52 e AHA1 da solo potrebbe avviare le caratteristiche patologiche che imitano il MA umano nei topi anziani di tipo selvaggio, quelli senza manipolazioni genetiche che predispongono il loro cervello ad aumentare anormalmente l'aggregazione della tau.
I risultati chiave del loro nuovo topo modello di taupatia includono:
- Alti livelli di FKBP52, e in misura minore di AHA1, aumentano l'accumulo di tau nel tempo, nei topi invecchiati e di tipo selvaggio.
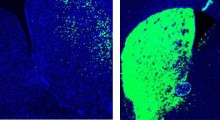
- L'accumulo di tau, promosso dalla sovra-espressione di FKBP52, ma non di AHA1, si correla a maggiore neuroinfiammazione attraverso l'attivazione esagerata delle cellule di supporto neuronali, ovvero microglia e astrociti. Ciò è stato integrato dalla perdita di neuroni e deterioramento cognitivo.
I topi modello esistenti, compresi quelli con geni aggiunti o sottratti, introducono mutazioni tau e seminano il cervello dei topi con tau umana, aiutando gli scienziati a capire meglio le cause sottostanti il MA e le altre taupatie. Tuttavia, tendono ad essere limitati nel catturare gli aspetti fisiologici della neurodegenerazione nel contesto dell'invecchiamento, sia normale che anormale.
"Speriamo che questo modello (squilibrio dei chaperoni) ci aiuti a capire meglio le dinamiche dell'aggregazione tau e della neuroinfiammazione, compresi i tempi e le connessioni tra gli eventi patologici, senza regolare direttamente un percorso o l'altro", ha detto la dott.ssa Blair.
La squadra della dott.ssa Blair ha progettato studi ulteriori per aiutare a svelare se, e quando, è più influente l'accumulo di tau o la neuroinfiammazione nel causare la tossicità della cellula cerebrale durante l'invecchiamento. Ciò potrebbe aiutare a determinare quali chaperoni (FKBP52, AHA1 o altri) possono essere i migliori obiettivi terapeutici per ripristinare l'equilibrio delle proteine, ha detto.
Fonte: Anne DeLotto Baier in University of South Florida (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Marangelie Criado-Marrero, Niat Gebru, Danielle Blazier, Lauren Gould, Jeremy Baker, David Beaulieu-Abdelahad, Laura Blair. Hsp90 co-chaperones, FKBP52 and Aha1, promote tau pathogenesis in aged wild-type mice. Acta Neuropathologica Communications, 8 Apr 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV