
Ora che la porta della FDA è stata aperta e allargata per i farmaci di Alzheimer che possono dimostrare una riduzione dell'amiloide, Biogen e i suoi partner della Eisai stanno spingendo per un rapido OK sul prossimo farmaco che segue il controverso percorso dell'aducanumab.
In una presentazione agli analisti finanziari, il responsabile di neurologia della EISAI, Ivan Cheung, ha delineato alcune aspettative ottimiste per il loro trattamento di nuova approvazione e ha preparato il palcoscenico per ciò che crede sarà l'ulteriore seguito per il BAN2401 (lecanemab), dopo un'astinenza di nuovi farmaci durata quasi 20 anni.
Dice Cheung:
"Sotto la rivoluzionaria definizione di terapia della FDA, abbiamo avviato colloqui con la FDA per cercare la via regolatrice ottimale e accelerata per il lecanemab. Esploreremo tutte le opzioni con la FDA, ascolteremo i loro consigli, incluso il percorso di approvazione accelerato".
Questa osservazione viene subito dopo le osservazioni di Dave Ricks, CEO della Eli Lilly, sui loro piani per spingere una richiesta BLA per il donanemab. Amplifica anche i commenti che Al Sandrock, capo R&S di Biogen, ha fatto due settimane fa, quando ha dichiarato che le due società "faranno tutto il possibile per accelerare il percorso regolamentare" del BAN2401.
Michael Yee, un potenziatore commerciale risoluto della Biogen, ha notato:
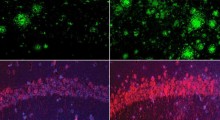
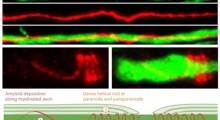
"Il BAN-2401 ha un effetto di riduzione della placca molto forte simile al LLY, anche se il ROG potrebbe avere un effetto minore. Il BAN2401 può anche avere meno effetti collaterali ARIA rispetto all'Aduhelm e non richiede la titolazione (anche se è dosato ogni 2 mesi invece dell'Aduhelm dosato ogni mese)".
Sia il BAN2401 che il donanemab sono stati benedetti con lo status di BTD subito dopo che l'approvazione dell'aducanumab ha innescato un crescendo di attacchi feroci alla FDA per aver dato la luce verde in base all'eliminazione dell'amiloide e per quello che i regolatori hanno sentito la ragionevole aspettativa che il biomarcatore avrebbe puntato al miglioramento del declino cognitivo per un enorme numero di pazienti di Alzheimer.
Nell'adottare la posizione di Biogen su un biomarcatore non provato, ignorando l'opposizione virtualmente unanime del gruppo di esperti esterni della FDA, l'agenzia ha innescato una tempesta di critiche. I principali ospedali hanno rifiutato di offrire immediatamente il farmaco perché i critici urlavano per l'assenza di qualsiasi dato solido che dimostra che funziona.
L'ICER (ente indipendente di valutazione dei farmaci) ha condannato il prezzo di $ 56.000 come interamente ingiustificato. I medici sono preoccupati per gli eventi avversi comuni come il gonfiore cerebrale e i micro-sanguinamenti. E la reazione ha spinto a una revisione di Medicare su come coprire il farmaco e a una richiesta del capo pro-tempore della FDA Janet Woodcock di un'indagine sul suo rapporto con la Biogen viste le domande sorte sui contatti tra dirigenti dell'azienda e Billy Dunn, capo di neurologia della FDA.
Niente di tutto ciò, però, sta impedendo ai produttori di farmaci di cogliere il momento dopo anni di frustrazioni in clinica. Gli analisti si aspettano che numerosi farmaci (Aduhelm, donanemab, Ban2401 e gantenumab di Roche) potrebbero raccogliere decine di miliardi di dollari in vendite annuali.
Con una serie di nuovi mega successi commerciali diretti evidentemente al mercato, le polemiche e le reazioni degli esperti sembrano un piccolo prezzo da pagare.
Fonte: John Carroll in Endpoints News (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV