Uno studio rivoluzionario dimostra il ruolo fondamentale della proteina p62 nel sopprimere i disturbi neurodegenerativi attraverso l'autofagia selettiva.
Le malattie neurodegenerative come l'Alzheimer e il Parkinson sono definite dall'accumulo patogeno di proteine tossiche nel cervello. Ora, scienziati dei National Institutes for Quantum Science and Technology (NIQS) in Giappone hanno stabilito che la proteina p62, che è coinvolta nella degradazione delle proteine cellulari, può prevenire l'accumulo di specie tau oligomeriche tossiche nel cervello di topo, dimostrando - per la prima volta - la funzione 'neuroprotettiva' della p62 in un modello vivente.
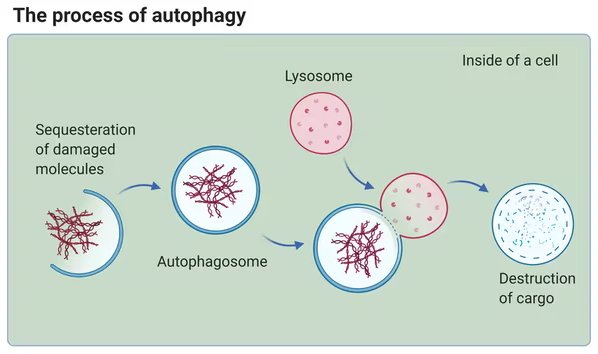
Al fine di mantenere l'omeostasi cellulare (cioè uno stato di equilibrio), le cellule subiscono l'autofagia selettiva, l'auto-degradazione di proteine indesiderate. I recettori dell'autofagia controllano questo processo, mediando la selezione di una proteina bersaglio che viene quindi 'eliminata'.
Le proteine tau, che altrimenti hanno un ruolo importante nella stabilizzazione e nel mantenimento dell'organizzazione interna dei neuroni nel cervello, si accumulano in modo abbondante all'interno dei neuroni in condizioni come la demenza e l'Alzheimer. Questo accumulo di proteine tau iper-fosforilate (o oligomeri di tau) provoca la formazione di grovigli neurofibrillari e infine della morte dei neuroni nel cervello delle persone con demenza, contribuendo ai sintomi neurodegenerativi progressivi della malattia.
Ora, mentre le proteine tau possono essere degradate dall'autofagia selettiva, l'esatto meccanismo di come ciò si verifica rimane un mistero. Con una svolta recente, tuttavia, uno studio pubblicato su Aging Cell e condotto da scienziati dei NIQS che includono il ricercatore Maiko Ono e il leader del gruppo Naruhiko Sahara, ha dimostrato il ruolo cruciale del gene p62 nell'autofagia selettiva degli oligomeri tau.
Precedenti studi hanno riferito che l'accumulo anormale delle proteine tau può essere soppresso selettivamente dai percorsi dell'autofagia, attraverso la proteina recettore p62 (che è una proteina recettore autofagico selettivo). Maiko Ono dice:
"La capacità di questa proteina di legarsi all'ubiquitina aiuta a identificare gli aggregati proteici tossici (come gli oligomeri tau), che possono quindi essere degradati da processi e organelli cellulari".
La novità di questo studio, tuttavia, risiede nella dimostrazione del ruolo 'neuroprotettivo' della p62 in un modello vivente, che non era mai stato visto prima. I ricercatori hanno acquisito questo risultato usando topi modello di demenza. In un gruppo di questi topi hanno eliminato il gene p62, e quindi non potevano più esprimere le proteine recettore p62.
Studiando il cervello di questi topi con analisi biochimiche di immunocolorazione e comparative, è emerso un quadro interessante. Gli aggregati di proteine tau neurotossiche sono stati trovati nell'ippocampo (l'area del cervello associata alla memoria) e nel tronco encefalico (il centro che coordina la respirazione, il battito cardiaco, la pressione sanguigna e altri processi volontari del corpo) dei topi senza p62.
Quando si considera ciò insieme ai sintomi di demenza, che includono perdita di memoria, confusione e cambiamenti dell'umore, questi risultati hanno molto senso.
Le scansioni MRI hanno rivelato che l'ippocampo dei topi senza p62 era degenerato (atrofizzato) e infiammato. Una valutazione post mortem del loro cervello ha rivelato una perdita grave di neuroni nell'ippocampo. Ulteriori studi a immunofluorescenza hanno dimostrato che gli aggregati delle specie anormali di tau possono causare citotossicità che porta all'infiammazione e alla morte cellulare dei neuroni nei topi senza p62. La tau oligomerica, in particolare, si era accumulata di più nel cervello dei topi senza p62.
Nel complesso, i risultati di questo studio dimostrano che eliminando le specie oligomeriche di tau e, quindi, impedendone l'aggregazione nel cervello, la p62 ha un ruolo neuroprotettivo nei modelli di demenza.
Nel momento in cui i ricercatori in tutto il mondo stanno cercando di sviluppare farmaci per la demenza e per gli altri disturbi neurodegenerativi correlati, i risultati di questo studio saranno di grande importanza nel fornire evidenze per puntare in modo accurato gli oligomeri di tau.
La popolazione globale di esseri umani che invecchia è in aumento ogni anno; di conseguenza, sta crescendo anche la necessità di sviluppare metodi per rallentare l'insorgenza e la progressione di varie malattie neurodegenerative. Questo studio costituisce un passo positivo per affrontare tale necessità.
Fonte: National Institutes for Quantum Science and Technology (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Maiko Ono, ...[+12], Makoto Higuchi. Central role for p62/SQSTM1 in the elimination of toxic tau species in a mouse model of tauopathy. Aging Cell, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV