Dei ricercatori hanno acquisito preziose informazioni sullo sviluppo delle malattie da prioni del cervello.
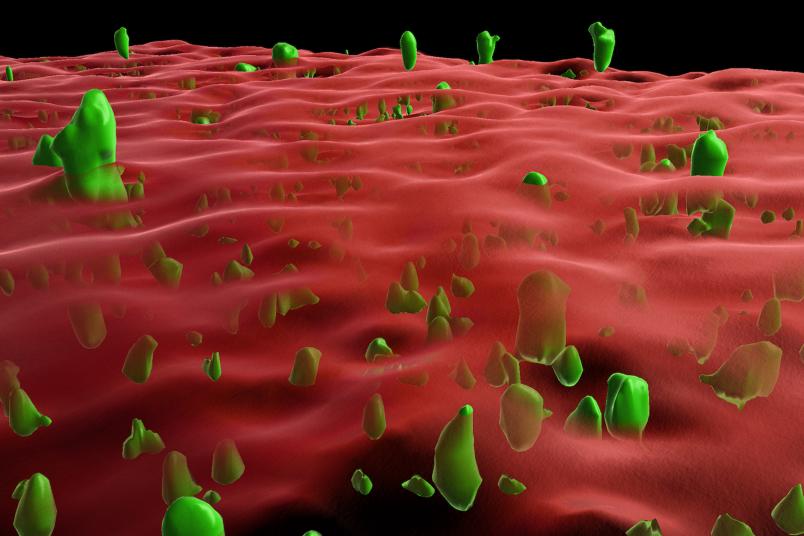 Ricostruzione 3D di immagine al microscopio: il rosso è la membrana e in verde grumi di proteine prioni. (Fonte: © AG Tatzelt, Gogte et al / PNAS)
Ricostruzione 3D di immagine al microscopio: il rosso è la membrana e in verde grumi di proteine prioni. (Fonte: © AG Tatzelt, Gogte et al / PNAS)
L'aggregazione proteica è tipica di varie malattie neurodegenerative come l'Alzheimer, il Parkinson e le malattie da prioni come la Creutzfeld-Jakob.
Un team di ricerca guidato dal professor Jörg Tatzelt del Dipartimento di Biochimica delle Malattie Neurodegenerative della Ruhr University di Bochum, in Germania, ha ora usato nuovi modelli di coltura cellulare e in vitro per dimostrare che un'ancora lipidica sulla membrana esterna inibisce l'aggregazione della proteina prione, e ha pubblicato lo studio su Proceedings of the National Academy of Sciences (PNAS).
"Comprendere i meccanismi che causano la trasformazione delle proteine originariamente piegate in forme patogene è di fondamentale importanza per lo sviluppo di strategie terapeutiche", afferma Jörg Tatzelt.
Forme ereditarie e infettive della malattia
Le malattie da prioni sono degenerazioni fatali del cervello, associate alla trasformazione della proteina prione cellulare (PrPC) dalla sua piega sana in aggregato patologico, cioè la proteina prione [[scrapie]] (PrPSC), [una encefalopatia spongiforme trasmissibile simile alla encefalopatia spongiforme bovina o mucca pazza, che colpisce pecore e capre (da Wikipedia)].
Pur essendo rare nell'uomo, le malattie da prioni ereditarie sono innescate da mutazioni genetiche, alcune delle quali influenzano l'ancoraggio della PrPC alla membrana cellulare. Tuttavia, non è ancora completamente chiaro come questi cambiamenti possano esattamente innescare le malattie da prioni.
Per ottenere nuove intuizioni sui processi sottostanti, i ricercatori hanno sviluppato nuovi modelli per esplorare il ruolo di un'ancora di membrana sulla piegatura e l'aggregazione di PrP in vitro e nelle cellule neuronali. Gli esperimenti hanno dimostrato che l'ancoraggio alle membrane stabilizza il ripiegamento di PrP e inibisce efficacemente l'aggregazione.
"La cosa interessante è che il raggruppamento di PrP ancorato a membrana potrebbe essere indotto da aggregati proteici preformati", afferma Jörg Tatzelt. "Questo è un meccanismo che potrebbe avere un ruolo nelle malattie infettive da prioni".
Fonte: Meike Drießen in Ruhr-University Bochum (> English) - Traduzione di Franco Pellizzari.
Riferimenti: K Gogte, [+8], J Tatzelt. Topological confinement by a membrane anchor suppresses phase separation into protein aggregates: Implications for prion diseases. PNAS, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV