Un gran numero di malattie derivano da proteine mal ripiegate, molecole composte da aminoacidi.
I ricercatori dell'Università di Zurigo, con una tecnica spettroscopica speciale, hanno studiato il misfolding [errato ripiegamento], che, come ci relazionano nella rivista Nature, è più frequente se, la sequenza degli amminoacidi nelle aree vicine alla proteina, è molto simile.
|
|
Le proteine sono le principali macchine molecolari nel corpo; svolgono una vasta gamma di funzioni, dalla digestione e l'elaborazione di sostanze nutritive, alla conversione di energia, all'aiuto alla struttura cellulare della trasmissione dei segnali nelle cellule e in tutto il corpo.Per eseguire queste funzioni molto specifiche, le proteine devono adottare una ben definita struttura tridimensionale. Sorprendentemente, nella maggioranza dei casi, trovano questa struttura senza aiuto, una volta che si sono formate fuori dei loro singoli elementi, gli aminoacidi, come molecole a lunga catena all'interno della cellula. Però il processo di piegatura può anche fallire, il che significa che le proteine colpite non sono più in grado di svolgere la loro funzione. In alcuni casi, questo può anche avere conseguenze molto più gravi, quando queste proteine senza piegatura si raggruppano e scatenano patologie neurodegenerative come l'Alzheimer o il Parkinson.
Nel corso dell'evoluzione, un fattore cruciale per lo sviluppo delle proteine è stato così evitare tali "processi di misfolding". Tuttavia, questo non è un compito facile, poiché le stesse interazioni molecolari che stabilizzano la corretta struttura delle singole proteine possono portare anche a interazioni tra molecole di proteine, facendone fallire la piegatura.
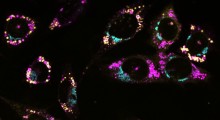
Utilizzando uno speciale metodo spettroscopico chiamato fluorescenza di singola molecola, i ricercatori delle Università di Zurigo e di Cambridge hanno studiato le circostanze in cui si verifica il misfolding.
Il team, guidato dal Prof. Benjamin Schuler dell'Università di Zurigo, ha studiato sezioni, o "domini", della più grande proteina nel nostro corpo, la titina, che aiuta la stabilità e l'elasticità delle fibre muscolari. Si presume che singoli domini di titina possano aprirsi mentre il muscolo è sotto forte sforzo per evitare di danneggiare il tessuto muscolare. Quando il muscolo si rilassa di nuovo, tuttavia, vi è il pericolo che tali domini aperti possano ripiegarsi in modo errato. C'è anche un rischio simile per altre proteine multidominio.
Nello studio i ricercatori hanno attaccato piccole molecole di colorante come sonde nella proteina. "Con il nostro metodo di spettroscopia laser, siamo stati in grado di determinare le distanze su scala molecolare, cioè fino a pochi milionesimi di millimetro, attraverso il trasferimento di energia tra le sonde", spiega il Prof. Schuler. Ciò ha permesso di distinguere le strutture di proteine ripiegate bene o male, e quindi determinare la percentuale di misfolding.
"Lo studio di diversi domini di titina nei nostri esperimenti hanno rivelato che la probabilità di misfolding aumenta se i domini confinanti sono molto simili nella loro sequenza di aminoacidi" dice il professor Schuler. Questo è apparentemente il motivo per cui i domini confinanti nelle proteine hanno un grado limitato di somiglianza. "Questa sembra essere una strategia evolutiva chiave per evitare il misfolding delle proteine e quindi garantire la loro massima funzionalità" dice Schuler.
Fonte: Materiale dell' Università di Zurigo.
Riferimento: Madeleine B. Borgia, Alessandro Borgia, Robert B. Best, Annette Steward, Daniel Nettels, Bengt Wunderlich, Benjamin Schuler, Jane Clarke. Single-molecule fluorescence reveals sequence-specific misfolding in multidomain proteins. Nature, 2011; DOI: 10.1038/nature10099
Pubblicato in ScienceDaily il 4 giugno 2011 - Traduzione di Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi, eventualmente citati nell'articolo, sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non si propone come terapia o dieta; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer Riese. I siti terzi raggiungibili dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente; in particolare si segnala la presenza frequente di una istituzione medica con base in Germania (xcell-Center) che propone la cura dell'Alzheimer con cellule staminali; la Società Tedesca di Neuroscienze ha più volte messo in guardia da questa proposta il cui effetto non è dimostrato. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione, una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e a informarti: |








 Associazione Alzheimer OdV
Associazione Alzheimer OdV