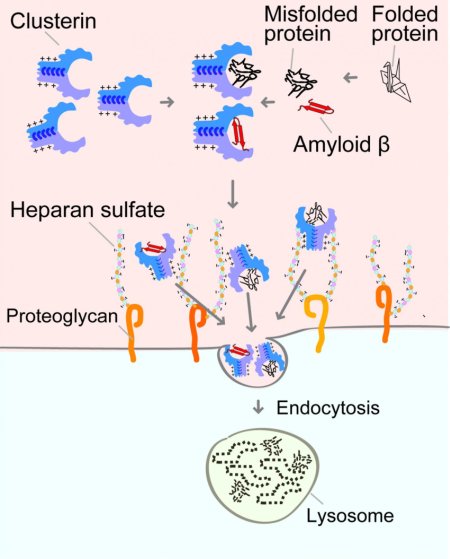
 Ecco come la clusterina porta le proteine mal ripiegate e l'amiloide-beta nelle cellule dove possono essere degradate dai lisosomi. Fonte: Itakura et al., 2020L'accumulo di proteine aberranti nel corpo causa varie malattie neurodegenerative. L'amiloide-β, una di queste proteine aberranti, è un noto fattore di rischio per il morbo di Alzheimer (MA).
Ecco come la clusterina porta le proteine mal ripiegate e l'amiloide-beta nelle cellule dove possono essere degradate dai lisosomi. Fonte: Itakura et al., 2020L'accumulo di proteine aberranti nel corpo causa varie malattie neurodegenerative. L'amiloide-β, una di queste proteine aberranti, è un noto fattore di rischio per il morbo di Alzheimer (MA).
Eisuke Itakura, un assistente professore all'Università di Chiba, dice:
"Le cellule umane hanno delle funzioni per mantenere l'[[omeostasi]] (= stabilità, equilibrio). Gli scienziati stanno ora studiando attivamente i sistemi di degradazione delle proteine intracellulari tipici dell'[[autofagia]] e del [[proteasoma]], ma la nostra conoscenza di come le cellule agiscono sulle sostanze esterne aberranti è tuttora limitata".
Con esperimenti in capsule di Petri, il gruppo di ricerca guidato da Itakura ha acquisito nuove conoscenze sulle funzioni che hanno le cellule umane per mantenere l'omeostasi. Il team ha scoperto un sistema nel quale le cellule possono catturare, degradare e rimuovere le proteine extracellulari aberranti. Questo studio è stato pubblicato il 18 Febbraio sul Journal of Cell Biology.
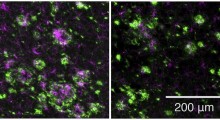
In questi esperimenti, il team si è concentrato sulla clusterina, un chaperone (= cicerone, guida) molecolare extracellulare. Sviluppando un saggio originale proprietario di internalizzazione cellulare, in cui le cellule diventano fluorescenti quando assorbono clusterina extracellulare, hanno stabilito un nuovo metodo per osservare visivamente lo stato della proteolisi nel corpo (vedi figura iniziale).
La squadra di Itakura ha scoperto che la clusterina extracellulare si lega selettivamente alle proteine aberranti e forma un complesso. Usando poi il saggio di fluorescenza e lo screening CRISPR dell'intero genoma, hanno osservato come le cellule riprendono questo complesso.
Il team ha scoperto che le cellule prive di un gene correlato al recettore 'solfato eparan' sulla superficie cellulare non prendono il complesso aberrante della proteina clusterina. Hanno anche dimostrato che le cellule potrebbero prendere il complesso clusterina con l'amiloide-β attraverso il recettore solfato eparan e che il complesso è degradato negli organelli lisosomi.
"La clusterina è un tipo di chaperone molecolare che si lega alle proteine immature per proteggerle. Se riusciremo a sviluppare artificialmente clusterina che si lega facilmente all'amiloide-β e a iniettarla nel corpo, potrebbe essere un trattamento per il MA", spiega Itakura.
Il recettore solfato eparan era finora conosciuto come recettore del fattore di crescita e virale. Questa è la prima volta che gli scienziati dimostrano che è un recettore di proteine anomale. Il gruppo di ricerca ha chiamato questo sistema di omeostasi percorso di 'degradazione delle proteine extracellulari mediato da chaperoni e recettori' (CRED, chaperone- and receptor-mediated extracellular protein degradation), e ora stanno progettando di applicarlo al trattamento della malattia attraverso ulteriore ricerca.
Fonte: Chiba University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Eisuke Itakura, Momoka Chiba, Takeshi Murata, Akira Matsuura. Heparan sulfate is a clearance receptor for aberrant extracellular proteins. Journal of Cell Biology, 18 Feb 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV