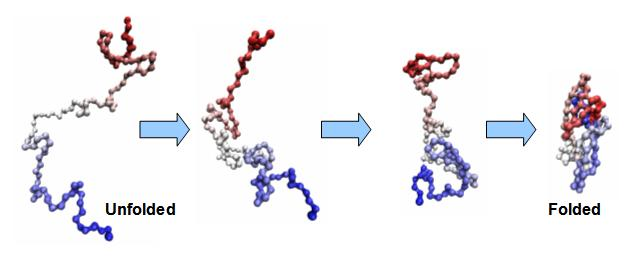
I ricercatori dell'Università di Cambridge, di Google Research e dell'Università di Milano hanno usato tecniche di apprendimento automatico per prevedere come le proteine, in particolare quelle implicate nelle malattie neurologiche, cambiano completamente la loro forma in pochi microsecondi.
Hanno scoperto che quando l'amiloide-beta (Aβ), una proteina chiave implicata nel morbo di Alzheimer (MA), adotta un insieme di forme disordinate, diventa in realtà meno prona a attaccarsi e formare i grumi tossici che portano alla morte delle cellule cerebrali.
I risultati, riferiti sulla rivista Nature Computational Science, potrebbero aiutare nel futuro sviluppo di trattamenti per malattie che coinvolgono le proteine disordinate, come il MA e il Parkinson.
"Siamo abituati a pensare alle proteine come molecole che si piegano in strutture ben definite: scoprire come avviene questo processo è stato un importante epicentro di ricerca degli ultimi 50 anni", ha detto il professor Michele Vendruscolo del Centre for Misfolding Diseases di Cambridge, che ha diretto la ricerca. "Tuttavia, circa un terzo delle proteine nel nostro corpo non si piega, e rimangono invece in forme disordinate, come spaghetti in una zuppa".
Non sappiamo molto del comportamento di queste proteine disordinate, dal momento che i metodi tradizionali tendono ad affrontare il problema della determinazione delle strutture statiche, non delle strutture in movimento. L'approccio sviluppato dai ricercatori sfrutta il potere dell'infrastruttura di calcolo remoto (cloud computing) di Google per generare un numero elevato di traiettorie brevi.
"Le vaste simulazioni del computer ci permettono di catturare i movimenti a livello molecolare di migliaia di copie di una proteina in parallelo, e di riprodurli come un film", ha detto il coautore dott. Kai Kohlhoff di Google Research.
I tipi più comuni di movimenti si presentano più volte in questi film, rendendo possibile definire le frequenze con cui le proteine disordinate passano tra i diversi stati.
"Contando questi movimenti, possiamo prevedere quali stati occupa la proteina e la rapidità con cui transita tra loro", ha detto il primo autore Thomas Löhr del Dipartimento di Chimica di Cambridge.
I ricercatori si sono focalizzati sul peptide Aβ, un frammento proteico associato al MA, che si aggrega formando placche amiloidi nel cervello degli individui colpiti. Hanno scoperto che l'Aβ salta tra stati ampiamente diversi milioni di volte al secondo senza mai fermarsi in nessuno stato particolare. Questo è il segno distintivo del disordine, e la ragione principale per cui l'Aβ è considerata finora 'non agguantabile'.
"Il movimento costante dell'Aβ è uno dei motivi per cui è stata così difficile da puntare; è quasi come cercare di prendere il fumo con le mani", ha detto Vendrusclo.
Tuttavia, studiando una variante di Aβ, in cui uno degli aminoacidi è modificato dall'ossidazione, i ricercatori hanno capito come renderla resistente all'aggregazione. Hanno scoperto che la forma di Aβ ossidata cambia forma ancora più velocemente della sua controparte non modificata, fornendo la logica che spiega la tendenza minore all'aggregazione della versione ossidata.
"Da una prospettiva chimica, questa modifica è un cambiamento minore. Ma l'effetto sugli stati e sulle transizioni tra loro è drastico", ha detto Löhr.
"Rendendo le proteine disordinate ancora più disordinate, possiamo impedire loro di auto-associarsi in maniere aberranti", ha affermato Vendruscolo.
L'approccio fornisce uno strumento potente per indagare su una classe di proteine con movimenti rapidi e disordinati, che finora sono rimaste elusive, nonostante la loro importanza in biologia e medicina.
Fonte: University of Cambridge (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Thomas Löhr, Kai Kohlhoff, Gabriella Heller, Carlo Camilloni, Michele Vendruscolo. A kinetic ensemble of the Alzheimer’s Aβ peptide. Nature Computational Science, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV