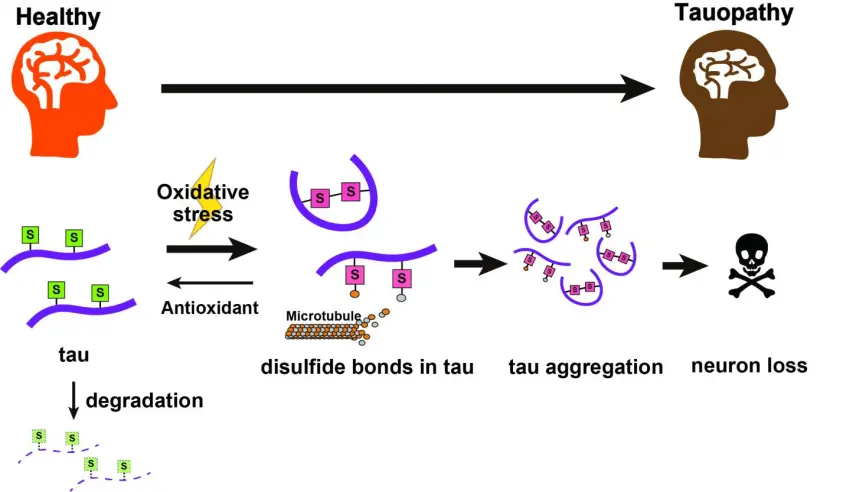
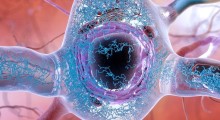
 Le proteine tau con gruppi di cisteina e di tiolo (S) subiscono cambiamenti chimici sotto stress ossidativo, formando legami disolfuri, e producendo un mutante tossico della proteina tau che può aggregarsi, con conseguente degenerazione neurale. Gli antiossidanti possono aiutare, riducendole di nuovo a tioli, che possono quindi essere eliminati naturalmente dalla cellula. Fonte: Tokyo Metropolitan University.
Le proteine tau con gruppi di cisteina e di tiolo (S) subiscono cambiamenti chimici sotto stress ossidativo, formando legami disolfuri, e producendo un mutante tossico della proteina tau che può aggregarsi, con conseguente degenerazione neurale. Gli antiossidanti possono aiutare, riducendole di nuovo a tioli, che possono quindi essere eliminati naturalmente dalla cellula. Fonte: Tokyo Metropolitan University.
Ricercatori della Tokyo Metropolitan University hanno scoperto che una caratteristica chimica specifica di una proteina cruciale chiamata tau può indurla ad accumularsi nel cervello e a innescare malattie come il morbo di Alzheimer (MA). Hanno scoperto che i legami disolfuri su alcuni aminoacidi agiscono per (de)stabilizzare la tau e a indurla ad accumularsi, un effetto che peggiora con più stress ossidativo. Identificare gli obiettivi chimici che innescano l'accumulo della tau può portare a trattamenti innovativi.
La proteina tau è la chiave per una funzione sana delle cellule biologiche. Aiuta a formare e stabilizzare i microtubuli, i filamenti sottili che solcano gli interni cellulari, aiutandoli a restare strutturalmente rigidi e forniscono le 'autostrade' per trasportare le molecole tra gli organelli. Tuttavia, quando la proteina non è piegata correttamente, può accumularsi e formare ciuffi appiccicosi.
Nel cervello, questi aggregati bloccano lo sparo dei neuroni e causano una vasta gamma di malattie neurodegenerative conosciute come taupatie, una delle quali è il MA. È molto importante che gli scienziati trovino l'«interruttore» che trasforma la tau da parte indispensabile della funzione cellulare a patologia mortale.
Una squadra guidata dal prof. associato Kanae Ando della Tokyo Metropolitan University ha usato organismi modelli, come il moscerino della frutta Drosophila, per scoprire le caratteristiche specifiche della proteina tau che interrompono il suo funzionamento corretto. I moscerini possono essere modificati geneticamente per esprimere la stessa proteina tau umana. Modificando sistematicamente parti del gene che codifica la tau, hanno cercato di capire il modo in cui determinate caratteristiche delle proteine tau mutanti ne influenzano il comportamento.
Nel loro lavoro più recente, hanno scoperto che le alterazioni ai residui di amminoacidi in due punti diversi (C291 e C322) della proteina 'cisteina', hanno avuto un effetto drastico sulla quantità e sulla tossicità della tau. In un'ulteriore svolta, il team ha bloccato la caratteristica chimica specifica responsabile di renderla tossica per la normale funzione cellulare, cioè i legami disolfuri costituiti da questi gruppi di cisteine.
L'accumulo tossico della tau è peggiorato quando le cellule sono state messe in un ambiente con livelli elevati di specie reattive di ossigeno, poiché i gruppi di tiolo sulle cisteine si sono ossidati, formando legami disolfuri. Gli ambienti biochimici con sollecitazione ossidativa elevata sono simili a quelli osservati nei pazienti con taupatie. L'espressione concomitante di antiossidanti per contrastare questo effetto ha aiutato i processi naturali ad eliminare le proteine tau, con conseguente drastico abbassamento dei livelli di tau.
La squadra spera che, conoscendo esattamente quali gruppi chimici sono responsabili della tossicità della tau, si possa arrivare a nuove terapie che riducono o prevengono l'accumulo di tau, aiutando i malati di taupatie in tutto il mondo.
Fonte: Tokyo Metropolitan University via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Taro Saito, ..., Kanae Ando. Disulfide bond formation in microtubule-associated tau protein promotes tau accumulation and toxicity in vivo. Human Molecular Genetics, 17 June 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV