Nel mezzo delle pressioni per ottenere l'approvazione dalla FDA, una morte rivelata di recente aumenta i dubbi sulla sicurezza dell'anticorpo anti-amiloide.
Mentre monta l'entusiasmo per un nuovo anticorpo sperimentale che sembra rallentare il declino cognitivo in alcuni pazienti di morbo di Alzheimer (MA), una terza morte legata al farmaco durante i test clinici può amplificare le preoccupazioni per la sua sicurezza.
Science ha ottenuto cartelle cliniche di una donna della Florida di 79 anni, che ha partecipato a un esperimento ancora attivo sull'anticorpo, morta a metà settembre dopo aver sperimentato ampio gonfiore e sanguinamento del cervello, nonché convulsioni. Diversi neuroscienziati che hanno esaminato le registrazioni su richiesta di Science credono che sia molto probabile che la sua morte sia stata causata dall'anticorpo, il lecanemab.
"Il gonfiore del cervello e le micro-emorragie ... potrebbero essere un grave effetto collaterale del farmaco in studio", e dovrebbero essere valutati dagli investigatori dell'esperimento, afferma Ellis Van Etten, neuroscienziata e neurologa della Leiden University.
Lo sponsor dello studio clinico, l'azienda giapponese di biotecnologie Eisai Co., non ha divulgato questo decesso a un importante incontro di MA del mese scorso in cui ha fornito i dettagli della sperimentazione di fase 3 del lecanemab. La morte è arrivata in un prolungamento di quell'esperimento, ma alcuni scienziati affermano che comunque avrebbe dovuto essere citato alla conferenza.
"Non svelare questo caso da parte di Eisai e del co-sviluppatore Biogen ... è preoccupante e mina la mia fiducia sulla completezza dei dati di sicurezza segnalati", afferma Matthew Schrag, neurologo e neuroscienziato della Vanderbilt University, che ha esaminato i dati della donna.
La morte rivelata di recente si aggiunge ad altre segnalazioni di gravi casi di sanguinamento del cervello e gonfiore nell'esperimento clinico di base, e ad altre due morti nel prolungamento - il primo segnalato da STAT e il secondo da Science - che alcuni scienziati hanno collegato al lecanemab.
La Eisai, che ha attribuito le vittime precedenti e le lesioni cerebrali a fattori non correlati al lecanemab, ha rifiutato di commentare la morte della donna della Florida, citando le preoccupazioni sulla privacy dei pazienti. "Tutti gli eventi seri, compresi gli incidenti mortali, sono segnalati ad Eisai e considerati nella nostra valutazione dello studio", ha dichiarato un portavoce dell'azienda in un comunicato inviato a Science. "Queste informazioni sono fornite alla FDA [Food and Drug Administration] e ad altre autorità di regolamentazione", come pure al comitato indipendente di revisione dello studio.
Il portavoce ha aggiunto che l'età e le condizioni mediche di qualsiasi partecipante all'esperimento dovrebbero essere considerate quando si valuta una morte. La donna della Florida, tuttavia, non aveva problemi evidenti di salute, a parte i segni di MA, secondo la sua cartella clinica.
La Eisai ha citato 13 decessi nell'esperimento clinico principale, che aveva coinvolto circa 1.800 persone. I decessi sono previsti data l'età e la salute della popolazione dello studio, e la società afferma che i numeri erano simili in entrambi i gruppi, quello del lecanemab e quello del placebo. Ma non ha reso pubblico i dettagli di ogni morte, quindi nella maggior parte dei casi gli scienziati non sono stati in grado di valutare in modo indipendente se il lecanemab abbia contribuito alle vittime.
Il lecanemab è uno dei numerosi farmaci sperimentali di MA che puntano l'amiloide-beta (Aβ), la proteina che si accumula nel cervello delle persone con la malattia. Molti nel settore credono che sia responsabile della morte delle cellule cerebrali, che ruba i ricordi alle persone e alla fine le uccide, sebbene i depositi della proteina si trovino anche nel cervello di persone sane.
Gli anticorpi anti-amiloide spesso causano gonfiore e sanguinamento del cervello, una condizione nota come 'anomalie di scansione correlate all'amiloide' (ARIA, amyloid-related imaging abnormalities) perché è diagnosticata via scansione cerebrale. "Dobbiamo cambiarne il nome ... perché non sono solo anomalie di scansione, come dimostra questo caso", afferma Andreas Charidimou, neurologo e neuroscienziato della Boston University, che ha esaminato i dati della donna. "È una vera sindrome clinica, che può essere fatale".
Sebbene il lecanemab punti una versione solubile di amiloide-beta, si lega anche alle 'placche' extracellulari della proteina, considerate un segno distintivo del MA. Circa la metà dei pazienti di MA ha una condizione chiamata 'angiopatia cerebrale amiloide' (CAA), in cui le placche Aβ sostituiscono il muscolo liscio delle pareti dei vasi sanguigni. Quando gli anticorpi, come i lecanemab, tolgono quelle placche, i vasi sanguigni possono infiammarsi e indebolirsi, aumentando la suscettibilità alle ARIA.
I neurologi affermano che, nei due decessi precedenti legati al lecanemab, l'uso da parte dei pazienti di anticoagulanti ha peggiorato gonfiore e sanguinamento del cervello. La donna della Florida riceveva una dose minima dell'anticoagulante eparina dopo essere stata ricoverata in ospedale, ma diversi neurologi lo considerano un fattore che ha contribuito ai suoi improvvisi problemi e alla morte finale.
Non è chiaro se la donna abbia ricevuto infusioni dell'anticorpo o di un placebo durante l'esperimento centrale di 18 mesi. Ma ha avuto il farmaco per 6 settimane nel prolungamento, nel quale qualsiasi partecipante può optare per il trattamento. Prima dell'inizio del prolungamento, una scansione del cervello ha rivelato segni di alcune micro-emorragie, ma non erano abbastanza gravi da escluderla dal test.
Una delle figlie della donna ha fornito i documenti medici a Science e ha autorizzato la loro revisione da parte di altri. Per proteggere la privacy della famiglia, Science sta nascondendo i nomi del paziente, della figlia, di un'amica che ha aiutato la donna durante lo studio e il sito di sperimentazione clinica in cui la paziente ha ricevuto il lecanemab.
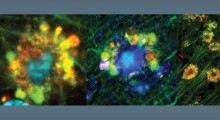
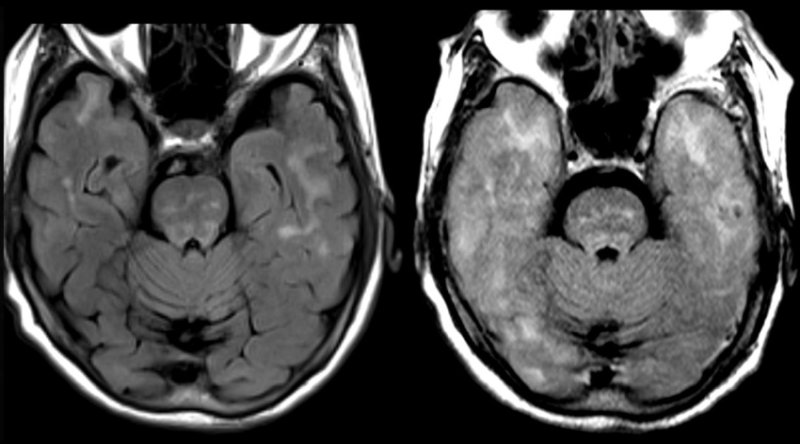 Nelle immagini MRI il gonfiore del cervello nella corteccia cerebrale - la grande sezione esterna del cervello - della donna della Florida morta dopo aver ricevuto il lecanemab. Prima del trattamento con l'anticorpo, la scansione della corteccia cerebrale (sinistra) rivela pieghe caratteristiche dei lobi temporali. Dopo (destra), il gonfiore estremo ha reso indistinguibili le pieghe. (Fornito anomimamente a Science)
Nelle immagini MRI il gonfiore del cervello nella corteccia cerebrale - la grande sezione esterna del cervello - della donna della Florida morta dopo aver ricevuto il lecanemab. Prima del trattamento con l'anticorpo, la scansione della corteccia cerebrale (sinistra) rivela pieghe caratteristiche dei lobi temporali. Dopo (destra), il gonfiore estremo ha reso indistinguibili le pieghe. (Fornito anomimamente a Science)
Un caso da manuale
L'amica della donna ha descritto una serie straziante di eventi che è iniziata con la prima infusione dell'anticorpo alla paziente, nell'ambito del prolungamento, ad agosto. “Era così stanca. Lei ... non si è alzata dal letto per 2 giorni oltre a mangiare forse uno yogurt o andare in bagno", dice l'amica. Un paio di settimane dopo, dopo la seconda infusione, la donna si lamentava di gravi mal di testa, "non riusciva più a completare le frasi" e si sentiva sempre più confusa sulle questioni quotidiane, ricorda la sua amica.
Il 14 settembre in un ristorante, la donna ha sperimentato quello che sembrava un ictus. È stata portata di corsa in ospedale, dove la sua amica ha informato i medici che la donna stava assumendo il farmaco sperimentale. Sono iniziate le convulsioni, che le facevano battere braccia e gambe, richiedendo restrizioni per la sua sicurezza.
Le scansioni cerebrali hanno mostrato dozzine di aree di sanguinamento e gonfiore del cervello, così estese che le pieghe caratteristiche della corteccia cerebrale erano "fuse e schiacciate" in parti sostanziali del suo cervello, afferma Charidimou, che chiama questo "un caso da manuale di ARIA grave, sia la presentazione clinica che le manifestazioni nelle scansioni". Data l'assenza di altre potenziali cause del danno cerebrale indicato nella cartella clinica, aggiunge, il lecanemab quasi certamente è il colpevole.
Le registrazioni dell'ospedale mostrano che l'investigatore del sito di sperimentazione clinica, contattato dopo che la donna è stata ricoverata in ospedale, ha sospetta le ARIA e ha sollecitato il trattamento con steroidi, che i medici hanno provato senza ottenere benefici significativi. La donna ha cominciato a soffrire di danno multiorgano e polmonite ed è morta 5 giorni dopo il ricovero.
"La paziente aveva un vasto gonfiore del cervello con alcune piccole aree di sanguinamento che le hanno fatto avere un attacco e alla fine l'hanno fatta morire", afferma Schrag, che è uno specialista CAA. "Sono convinto che questo sia stato un effetto collaterale del lecanemab".
Eric Smith, neurologo dell'Università di Calgary che ha esaminato i materiali del caso, concorda che il farmaco probabilmente ha causato la morte. In precedenza ha fatto consulenza per Biogen, partner di Eisai, ed è stato ricercatore per l'altro farmaco anti-amiloide aducanumab (Aduhelm) delle stesse società, che ha avuto l'approvazione dalla FDA l'anno scorso.
La famiglia ha organizzato un'autopsia, che poteva confermare che la donna aveva CAA e chiarire il ruolo dell'anticorpo nella sua morte, ma non è stata eseguita, dice la figlia. Il portavoce dell'Eisai ha dichiarato che la società "è scrupolosa e proattiva" nei suoi sforzi per ottenere informazioni sulla sicurezza, compresi i risultati dell'autopsia per i partecipanti al test.
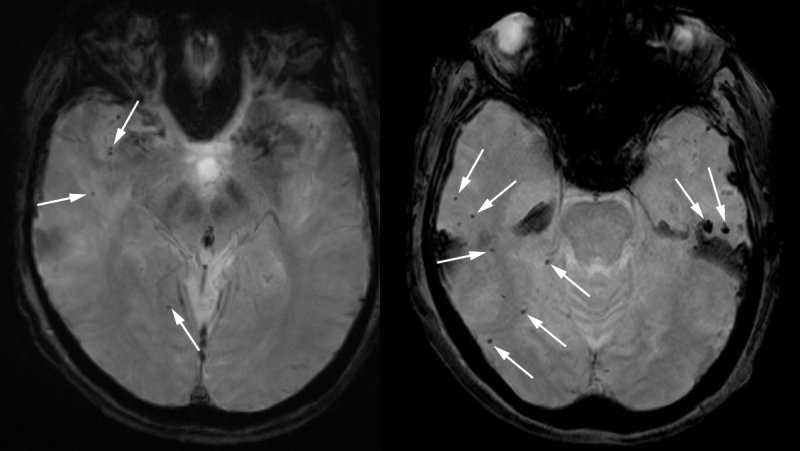 Prima che la donna della Florida ricevesse il lecanemab, una scansione MRI (sinistra) mostrava alcune microemorragie: piccoli sanguinamenti (macchie scure segnate da frecce). Dopo (destra), erano evidenti dozzine di microemorragie. (Fornita anonimamente a Science)
Prima che la donna della Florida ricevesse il lecanemab, una scansione MRI (sinistra) mostrava alcune microemorragie: piccoli sanguinamenti (macchie scure segnate da frecce). Dopo (destra), erano evidenti dozzine di microemorragie. (Fornita anonimamente a Science)
Mancanza di consenso
Le morti legate all'anticorpo suscitano dubbi sui recenti risultati di test visti come pieni di speranza. La Eisai ha riferito che il lecanemab ha rallentato il tasso di declino cognitivo tra i pazienti con Ma iniziale del 27% in media, su 18 mesi, un effetto statisticamente significativo. I neurologi non sono sicuri che quel beneficio possa essere evidente per molti pazienti o caregiver, e alcuni grandi sottogruppi nello studio, come le donne e gli under-65, non hanno tratto benefici statisticamente significativi.
Tuttavia, lo studio rappresenta il risultato più favorevole di qualsiasi altra terapia anti-amiloide testata finora e ha spinto alcuni scienziati e gruppi di pazienti di MA a chiedere alla FDA un rapida via libera per il farmaco.
All'inizio di questo mese, ha iniziato a circolare in rete una 'dichiarazione di consenso' sul lecanemab, i cui firmatari iniziali erano, o sono stati, consulenti per Eisai o Biogen, o hanno condotto ricerche per l'esperimento recente sul lecanemab. Quasi la metà degli oltre 200 scienziati o medici che hanno firmato la dichiarazione sono consulenti o beneficiari recenti di una o entrambe le società, secondo quanto verificato da Science. (Solo una parte di loro ha rivelato un conflitto di interessi.)
Il documento descrive il lecanemab come un "cambio di gioco fondamentale" per la malattia e richiede la sua approvazione e "nessuna barriera" alla sua disponibilità diffusa. Menziona possibili problemi di sicurezza associati alle ARIA ma non cita le morti e le gravi lesioni cerebrali che alcuni hanno collegato al farmaco. Entro il 6 gennaio 2023, la FDA dovrebbe decidere sull'approvazione del lecanemab e se richiedere avvertimenti o precauzioni.
Smith, che non ha firmato la lettera pro-lecanemab, riconosce che le persone con MA iniziale potrebbero ritenere che la possibilità di benefici cognitivi anche molto modesti valga il rischio di casi debilitanti di ARIA o persino di esiti fatali. Ma pensa che qualsiasi approvazione della FDA dovrebbe essere accompagnata da avvertimenti.
Un paziente di Alzheimer che riceve il lecanemab richiederebbe fino a 5 MRI ogni anno per monitorare adeguatamente le ARIA, dice, e sarebbe necessario un vasto programma di istruzione per garantire che i medici al di fuori dei principali centri medici possano riconoscere i problemi riscontrati nelle scansioni cerebrali. Smith invita inoltre la FDA a chiedere un registro che elenchi i problemi relativi alle ARIA, se e quando approverà il lecanemab.
Il portavoce di Eisai ha affermato che se il lecanemab sarà approvato, la società lavorerebbe con la FDA per garantire che i medici e i pazienti "comprendano come monitorare il paziente per gli effetti collaterali, come le ARIA", aggiungendo che "per molti pazienti i benefici supereranno i rischi".
***************
Aggiornamento: In una dichiarazione inviata a Science dopo la pubblicazione di questo articolo, la Eisai afferma di non aver rivelato la morte alla conferenza di Alzheimer di novembre "perché le informazioni fornite ad Eisai fino ad oggi non indicano che ci sia stato questo caso di ARIA o che ci fosse il sospetto che è collegato alla morte” e perché non ha finito di analizzare i dati del prolungamento dell'esperimento.
Fonte: Charles Piller in Science (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV