Un gruppo di ricerca dell'Institute of Neurosciences all'Università di Barcellona (Ubneuro) ha condotto uno studio che descrive un nuovo meccanismo molecolare che influisce sull'elaborazione dell'RNA e altera il processo di sintesi proteica nel cervello dei pazienti di Alzheimer. Lo studio, che è stato condotto in campioni post mortem di pazienti e in animali modello della malattia, potenzierà la progettazione di terapie future per affrontare il trattamento di questa demenza e altri disturbi neurologici.
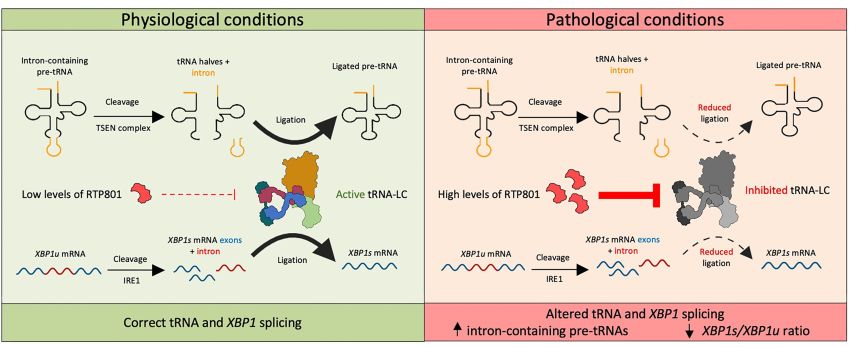 Riassunto grafico dello studio Campoy-Campos et al.
Riassunto grafico dello studio Campoy-Campos et al.
L'autrice senior Cristina Malagelada, prof.ssa della Facoltà di Medicina e Salute dell'UB e dell'Ubneuro, e il primo autore Genís Campoy-Campos, hanno pubblicato lo studio su Nucleic Acids Research.
Una nuova funzione per la proteina RTP801
Il morbo di Alzheimer (MA), il tipo più comune di demenza, che provoca un graduale declino delle capacità cognitive, della memoria e del linguaggio, nonché disturbi emotivi e psichiatrici, è caratterizzato dall'accumulo di placche di amiloide-β al di fuori dei neuroni e di proteine tau iperfosforilate al loro interno, che alterano la funzione cerebrale e causano la morte delle cellule.
Questo studio rivela un ruolo finora sconosciuto della proteina RTP801, un fattore di risposta allo stress che è abbondante nei pazienti con malattie neurodegenerative come il MA. Secondo lo studio, questa proteina può alterare i meccanismi molecolari che supportano la sopravvivenza neuronale, influenzando la traduzione dell'RNA in proteine.
La Malagelada spiega:
"Sapevamo già che la proteina RTP801, che si trova nei neuroni dell'ippocampo, era coinvolta nella patologia del MA, come da uno studio precedente pubblicato su Cell Death and Disease nel 2021. All'epoca, abbiamo scoperto che i livelli di questa proteina erano significativamente elevati sia nei topi modello di MA che nei campioni post mortem dei pazienti, e questi valori erano correlati alla progressione della malattia.
“A livello meccanicistico, abbiamo osservato che la riduzione dell'espressione di RTP801 ha impedito i deficit cognitivi e l'infiammazione, in particolare mitigando l'attivazione dell'inflammasoma ippocampale, vale a dire il macchinario che elabora le citochine nelle risposte infiammatorie e guida la gliosi (riattivazione e proliferazione di cellule gliali)".
Perché questo meccanismo è cruciale per la salute neuronale?
Lo studio descrive che il fattore RTP801 regola negativamente l'attività del 'complesso ligasi tRNA' (tRNA-LC), che è fondamentale per l'elaborazione di molecole di RNA. Nel contesto del MA, livelli più elevati di RTP801 possono inibire questo complesso e causare problemi nello splicing dell'RNA e nella successiva produzione di proteine rilevanti, come il fattore neurotrofico derivato dal cervello (BDNF), esacerbando i problemi cognitivi nei topi modello di MA.
Campoy-Campos osserva:
“In questo studio, abbiamo scoperto che livelli alti di RTP801 interferiscono con il tRNA-LC, che è responsabile dell'elaborazione dell'RNA, in particolare nel processo di legatura dei suoi esoni, una volta che gli introni sono stati scissi. Questo processo si svolge sia nell'RNA messaggero, che contiene le informazioni per costruire la proteina, che negli RNA di trasferimento, che portano gli aminoacidi per tradurla. Questo processo è vitale per la corretta sintesi di proteine nel ribosoma, gli organelli cellulari in cui avviene la traduzione dell'RNA in proteine.
“È interessante notare che questa interazione tra RTP801 e tRNA-LC influisce anche sulla legatura dell'RNA di un fattore di trascrizione chiamato XBP1S. Questo fattore aiuta le cellule a far fronte allo stress nel reticolo endoplasmatico - un organo formato da una serie di cisterne e caviità membranee nel citoplasma cellulare - e promuove l'espressione del BDNF, una neurotrofina cruciale per la trasmissione sinaptica, la memoria e la sopravvivenza neuronale”.
L'elaborazione alterata dell'RNA - una conseguenza di alti livelli di RTP801 - è molto dannosa per i neuroni, interrompendo la loro capacità di sintetizzare le proteine e di rispondere allo stress. Come sottolinea la Malagelada, questa elaborazione alterata dell'RNA aggiunge un nuovo componente tossico all'evoluzione finora conosciuta del MA:
"Ora portiamo al tavolo la tossicità degli RNA slegati e le sue conseguenze, come nuovo meccanismo neurodegenerativo nel MA".
Potenziare le terapie future per il trattamento delle malattie neurodegenerative
La scoperta di nuove funzioni della proteina RTP801 potrebbe aprire future opzioni terapeutiche per affrontare il trattamento delle patologie neurodegenerative e preservare la funzione cerebrale e la salute neuronale. In questo senso, la Malagelada sottolinea che:
"Se riuscissimo a progettare inibitori della proteina RTP801 - su cui stiamo attualmente lavorando - o preservare l'attività del tRNA-LC , potremmo bloccare specificamente le funzioni più tossiche di questo fattore e preservare processi neuronali essenziali. Questo offrirebbe una nuova gamma di opzioni terapeutiche innovative nel contesto di questi disturbi neurologici".
Fonte: Universidad de Barcelona (> English) - Traduzione di Franco Pellizzari.
Riferimenti: G Campoy-Campos, [+15], C Malagelada. RTP801 interacts with the tRNA ligase complex and dysregulates its RNA ligase activity in Alzheimer’s disease. Nucleic Acids Research, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV