Nel cervello con demenza si accumulano proteine piegate erroneamente; ricercatori dell'EMPA hanno ora definito una specie particolarmente attiva di fibrille proteiche con una precisione mai ottenuta prima.
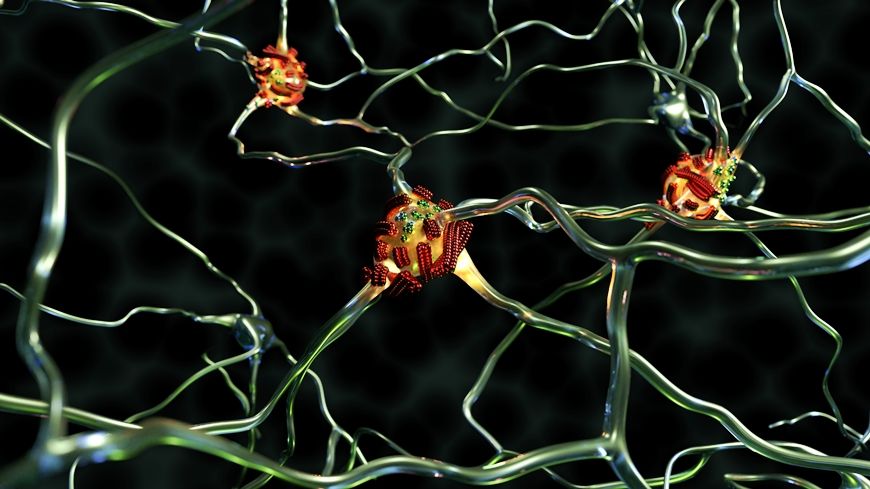 Molecole proteiche e fibrille sospette si aggregano sulle cellule nervose nella demenza. (Fonte: Empa)
Molecole proteiche e fibrille sospette si aggregano sulle cellule nervose nella demenza. (Fonte: Empa)
Il trattamento dei disturbi della demenza, come il morbo di Alzheimer (MA), è ancora una delle maggiori sfide che la medicina moderna deve affrontare. Nel decorso delle malattie neurodegenerative, nel cervello si accumulano alcune proteine, come l'amiloide-beta (Aβ), sospettate di essere legate allo sviluppo della malattia, motivo per cui sono considerate un obiettivo promettente per terapie.
Sappiamo già che le proteine mal ripiegate si raggruppano per formare strutture a forma di fibra, e tuttavia non era ancora completamente chiaro come si formano queste fibrille.
Ora, un team guidato da Peter Nirmalraj, ricercatore dell'EMPA di Dübendorf (Zurigo/Svizzera) e da scienziati dell'Università di Limerick in Irlanda, in uno studio pubblicato su Science Advances, è riuscito a mostrare come si svolge il processo, con una tecnica di scansione particolarmente potente. La cosa speciale di tutto ciò è che alcune delle fibrille di grandezza nanometrica apparentemente assicurano la diffusione della malattia nel tessuto cerebrale e sono quindi definite 'superspreader' (=superdiffusori).
Sottospecie tossiche
Questa sottospecie peculiare di fibrille proteiche ha attirato l'attenzione dei ricercatori a causa delle sue insolite proprietà: i bordi e le superfici delle cosiddette fibrille superspreader mostrano un'attività catalitica particolarmente elevata: in questi siti altamente attivi si accumulano nuovi blocchi che formano proteine. Di conseguenza, da questi siti di nucleazione si formano nuove fibrille a catena lunga. I ricercatori presumono che queste fibrille di seconda generazione alla fine si diffondono e formano nuovi aggregati nel cervello.
Conosciamo la composizione chimica della proteina Aβ mal ripiegata, ma finora era poco chiaro il meccanismo che induce i mattoni delle proteine a unirsi per formare fibrille di seconda generazione, nonché la loro forma e struttura.
"I metodi convenzionali, come quelli basati su tecniche di colorazione, potrebbero alterare la morfologia e il sito di assorbimento delle proteine così che non possono essere analizzate nella loro forma naturale", afferma Nirmalraj.
Precisione senza precedenti
La tecnica del ricercatore EMPA in questo nuovo studio è diversa: le proteine vengono analizzate invariate in una soluzione salina, che si avvicina molto di più alle condizioni naturali nel corpo umano, rispetto ai metodi convenzionali. Con il microscopio a forza atomica ad alta risoluzione, le fibrille, che hanno uno spessore di meno di 10 nanometri (1 nanometro = 1 miliardesimo di metro), possono essere fotografate con precisione senza precedenti a temperatura ambiente.
I ricercatori hanno potuto seguire il processo di formazione di fibrille in tempo reale, dai primi momenti alle 250 ore successive. Le analisi sono state quindi confrontate e integrate con calcoli del modello molecolare. Ciò ha permesso di classificare le fibrille in sottopopolazioni come "superspreader" in base alle loro strutture superficiali.
"Questo lavoro ci avvicina a capire meglio come queste proteine si diffondono nel tessuto cerebrale del MA", afferma il ricercatore Nirmalraj, che spera che ciò alla fine porti a nuovi modi per monitorare la progressione della malattia e a nuove procedure diagnostiche.
Fonte: EMPA (> English) - Traduzione di Franco Pellizzari.
Riferimenti: PN Nirmalraj, S Bhattacharya, D Thompson. Accelerated Alzheimer’s Aβ-42 secondary nucleation chronologically visualized on fibril surfaces. Science Advances, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV