Una nuova ricerca ha scoperto come inizia ad aggregarsi la proteina dannosa legata all'Alzheimer.
 Fonte: Image FX
Fonte: Image FX
Un nuovo studio su larga scala ha mappato i primi eventi molecolari che guidano la formazione di aggregati di proteine amiloidi dannose presenti nel morbo di Alzheimer (MA), indicando un nuovo potenziale bersaglio terapeutico.
Nello studio pubblicato su Science Advances, i ricercatori del Wellcome Sanger Institute, del Center of Genomic Regulation (CRG) e dell'Institute for Bioingingineering of Catalonia (IBEC) hanno usato genomica su larga scala e l'apprendimento automatico per studiare oltre 140.000 versioni del peptide chiamato Aβ42, che forma le placche dannose nel cervello e ha un ruolo centrale nel MA.
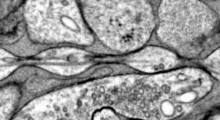
Questa ricerca è un passo significativo per aiutare gli scienziati a trovare nuovi modi per prevenire la malattia e i metodi usati nello studio potrebbero essere ampiamente applicati ad altre reazioni proteiche. L'amiloide-beta (Aβ) è un peptide, una catena corta di aminoacidi, che ha la tendenza ad ammassarsi e aggregarsi, formando strutture allungate chiamate fibrille amiloidi. Nel tempo, queste fibrille si saldano in placche che sono i segni patologici caratteristici di oltre 50 malattie neurodegenerative e in particolare hanno un ruolo centrale critico nel MA.
Perché i peptidi Aβ a flusso libero si convertano in fibrille strutturate e stabili, è richiesta una certa quantità di energia. Lo stato intermedio di breve vita, proprio prima che i peptidi inizino a formare una fibrilla, chiamato 'stato di transizione', è estremamente improbabile che si formi, motivo per cui le fibrille non si formano mai nella maggior parte delle persone. Comprendere queste strutture e reazioni è essenziale per sviluppare terapie che potrebbero trattare e prevenire le malattie neurodegenerative. Tuttavia, è molto difficile studiare stati di transizione ad alta energia di breve durata con metodi classici.
Quindi, capire come l'Aβ inizia ad aggregarsi rimane una grande sfida nella ricerca del MA. In questo nuovo studio i ricercatori hanno cercato di capire in che modo il cambiamento della genetica di Aβ influisce sul tasso della reazione di aggregazione. In particolare, i ricercatori hanno esaminato l'Aβ42, un tipo di peptide Aβ con 42 aminoacidi, presente comunemente nel MA. Il team ha usato una combinazione di tre tecniche per gestire contemporaneamente grandi quantità di informazioni sull'Aβ42:
- la sintesi di DNA massicciamente parallela per studiare in che modo il cambiamento degli aminoacidi nell'Aβ influisce sulla quantità di energia necessaria per formare una fibrilla,
- cellule di lievito progettate geneticamente per misurare questo tasso di reazione.
- l'apprendimento automatico, un tipo di intelligenza artificiale, per analizzare i risultati e generare un paesaggio energetico completo di reazione dell'aggregazione Aβ, mostrando l'effetto di tutte le possibili mutazioni di questa proteina sulla velocità con cui si formano le fibrille.
Queste tecniche hanno permesso ai ricercatori di condurre lo studio su larga scala e di esaminare contemporaneamente oltre 140.000 versioni di Aβ42. Questa scala non era mai stata ottenuta prima e aiuta a migliorare la qualità e l'accuratezza dei modelli sviluppati nello studio.
I ricercatori hanno scoperto che solo alcune interazioni chiave tra parti specifiche della proteina amiloide avevano una forte influenza sulla velocità di formazione della fibrilla. Hanno scoperto che la reazione di aggregazione di Aβ42 inizia alla fine della proteina, nota come regione C-terminale, uno dei nuclei idrofobici della proteina, la regione idrorepellente strettamente imballata del peptide. Poiché è qui che il peptide inizia ad aggregarsi in fibrilla, i ricercatori suggeriscono che sono le interazioni nella regione C-terminale a dover essere impedite per proteggere e trattare il MA.
Questa è la prima mappa su larga scala di come le mutazioni influenzano il comportamento di una proteina nello stato di transizione notoriamente difficile. Identificando le interazioni che guidano la formazione di fibrille amiloidi, il team ritiene che la prevenzione della formazione di questo stato di transizione potrebbe aprire la strada a nuove strategie terapeutiche, offrendo speranza per trattamenti futuri di MA. Inoltre, i ricercatori sottolineano l'ampia usabilità del loro metodo, rilevando che ha il potenziale per essere usato su una serie di proteine e malattie in altri studi.
Dott.ssa Anna Arutyunyan, prima coautrice, post-dottorato al Wellcome Sanger Institute: "Misurando gli effetti di oltre 140.000 versioni diverse di proteine, abbiamo creato la prima mappa completa di come le singole mutazioni alterano il panorama energetico dell'aggregazione Aβ, un processo centrale per lo sviluppo del MA. Il nostro modello guidato dai dati offre la prima visione ad alta risoluzione della reazione dello stato di transizione, aprendo la porta a strategie più mirate per l'intervento terapeutico”.
Dott-ssa Benedetta Bolognesi, coautrice senior e leader di gruppo all'Institute for Bioingineering of Catalonia: "Il nostro studio è nuovo per due ragioni: primo, il nostro metodo della 'selezione cinetica' misura la velocità con cui si verificano reazioni, e lo fa per migliaia di reazioni in parallelo, cogliendo le vere fasi limitanti della reazione di aggregazione. Secondo, combinando le mutazioni delle proteine, possiamo sondare sistematicamente le interazioni tra parti diverse della proteina mentre parte la reazione di aggregazione. Ciò è cruciale per capire i primi eventi nel processo di aggregazione proteica che porta alla demenza, ma offre anche un potente quadro per sezionare le principali fasi di inizio di molte reazioni biologiche, non solo quelle che abbiamo studiato finora. Non vedo l'ora di vedere tutti i modi in cui questa strategia sarò usata in futuro".
Professor Ben Lehner, coautore senior, capo di genomica generativa e sintetica al Wellcome Sanger Institute e professore di ricerca al Center for Genomic Regolation: "L'approccio che abbiamo usato in questo studio apre le porte a rivelare le strutture di altri stati di transizione proteica, compresi quelli implicati in altre malattie neurodegenerative. La scala su cui abbiamo analizzato i peptidi amiloidi non ha precedenti, è qualcosa che non è stato fatto prima e abbiamo dimostrato che è un nuovo e potente metodo da portare avanti. Speriamo che questo ci avvicini a sviluppare trattamenti contro il MA e altre condizioni neurodegenerative".
Fonte: Wellcome Trust Sanger Institute (> English) - Traduzione di Franco Pellizzari.
Riferimenti: A Arutyunyan, [+3], B Lehner. Massively parallel genetic perturbation suggests the energetic structure of an amyloid-β transition state. Sci. Adv, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV