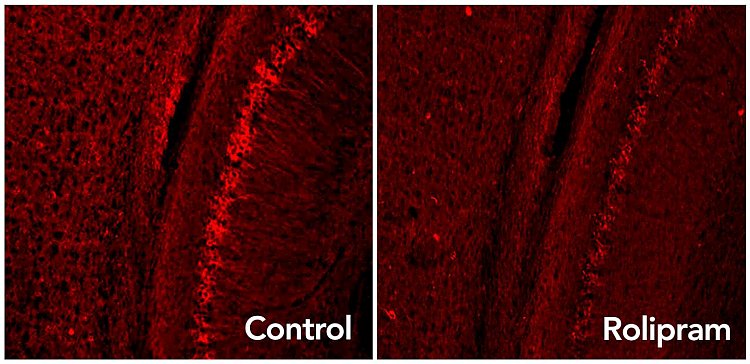
 Il farmaco Rolipram attiva il sistema di smaltimento dei rifiuti del cervello, eliminando le proteine Tau in eccesso (puntini rosso brillante) associate alle malattie neurodegenerative come l'Alzheimer (Fonte: Laboratorio di Karen Duff/Columbia University)
Il farmaco Rolipram attiva il sistema di smaltimento dei rifiuti del cervello, eliminando le proteine Tau in eccesso (puntini rosso brillante) associate alle malattie neurodegenerative come l'Alzheimer (Fonte: Laboratorio di Karen Duff/Columbia University)
Un farmaco che aumenta l'attività nel sistema di "smaltimento dei rifiuti" del cervello può diminuire i livelli di proteine tossiche associate all'Alzheimer e ad altre patologie neurodegenerative e migliorare la cognizione.
Questo però è stato provato solo nei topi da un nuovo studio condotto da neuroscienziati della Columbia University (CU), pubblicato ieri nell'edizione online di Nature Medicine.
"Abbiamo dimostrato per la prima volta che è possibile usare un farmaco per attivare questo sistema di smaltimento nei neuroni rallentando efficacemente la malattia", ha detto l'autrice senior dello studio Karen E. Duff PhD, professoressa di patologia e biologia cellulare (in psichiatria e al Taub Institute for Research on Alzheimer's Disease and the Aging Brain) della CU e dell'Istituto Psichiatrico dello Stato di New York. "Questo può potenzialmente aprire nuovi percorsi di trattamento per l'Alzheimer e molte altre malattie neurodegenerative".
Il farmaco usato è il rolipram, che provoca nausea e quindi non è un buon farmaco per gli esseri umani, ma dei farmaci simili non hanno la nausea come effetto secondario e potrebbero entrare molto rapidamente in studi clinici.
Per rimanere in buona salute, le cellule cerebrali devono continuamente eliminare le proteine vecchie e usurate o danneggiate, un compito svolto da un piccolo cilindro molecolare chiamato proteasoma. Il proteasoma agisce come una sorta di smaltimento dei rifiuti, macinando le vecchie proteine in modo che possano essere riciclate in nuove. Nelle malattie neurodegenerative, le proteine marcate per la distruzione si accumulano nei neuroni del cervello, suggerendo una alterazione dei proteasomi delle cellule.
Usando un topo modello di neurodegenerazione, i ricercatori hanno scoperto che la tau - una proteina tossica che si accumula nell'Alzheimer e in altre malattie degenerative del cervello - si attacca al proteasoma e rallenta il processo di smaltimento delle proteine. La somministrazione del rolipram attiva il proteasoma e ripristina l'eliminazione delle proteine a livelli normali. Il farmaco migliora anche la memoria dei topi malati ai livelli osservati nei topi sani.
Il rolipram era già stato provato in precedenza nei topi e aveva dimostrato di migliorare la memoria, ma il meccanismo di funzionamento non era chiaro. La nuova ricerca dimostra che, inibendo l'enzima PDE-4, il rolipram produce un cambiamento fisico nel proteasoma, aumentando la sua attività. "Non sappiamo ancora esattamente dove avviene l'attivazione, ma quello che c'è di nuovo è che possiamo modificare il proteasoma per aumentare la sua attività. Ci potrebbero essere molti altri modi per farlo", ha detto il primo autore dello studio, Natura Myeku PhD, un ricercatore associato di patologia e biologia cellulare alla CU.
I farmaci che puntano i proteasomi in questo modo dovrebbero funzionare per qualsiasi malattia causata da un accumulo di proteine anomale, tra cui l'Alzheimer, l'Huntington, il Parkinson e la demenza frontotemporale.
"I trattamenti che accelerano questi meccanismi di smaltimento delle cellule dovrebbero, in teoria, degradare solo le proteine anomale. Non abbiamo bisogno di sapere qual è la forma tossica della proteina", ha detto la dott.ssa Duff. "Nell'Alzheimer, ce ne sono almeno 4 tipi diversi: amiloide, tau, alfa-sinucleina e TDP43. Un proteasoma ben funzionante può eliminare tutto in una volta".
"Questa ricerca interessante del team della Dott.ssa Duff avanza la nostra comprensione di base del sistema proteasoma, fornisce un modo per riparare il sistema quando si rompe, e allevia i sintomi di malattie neurodegenerative", ha detto Rod Corriveau PhD, direttore del programma al National Institute of Neurological Disorders and Stroke, che ha fornito parte del finanziamento dello studio, assieme alla CurePSP Foundation, al National Institute of General Medical Sciences, alla Fidelity Biosciences Research Initiative e alla Multiple Myeloma Research Foundation.
I ricercatori dichiarano di non avere conflitti di interesse finanziario o di altro tipo.
Fonte: Columbia University via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Natura Myeku, Catherine L Clelland, Sheina Emrani, Nikolay V Kukushkin, Wai Haung Yu, Alfred L Goldberg & Karen E Duff. Tau-driven 26S proteasome impairment and cognitive dysfunction can be prevented early in disease by activating cAMP-PKA signaling. Nature Medicine (2015) doi:10.1038/nm.4011
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV