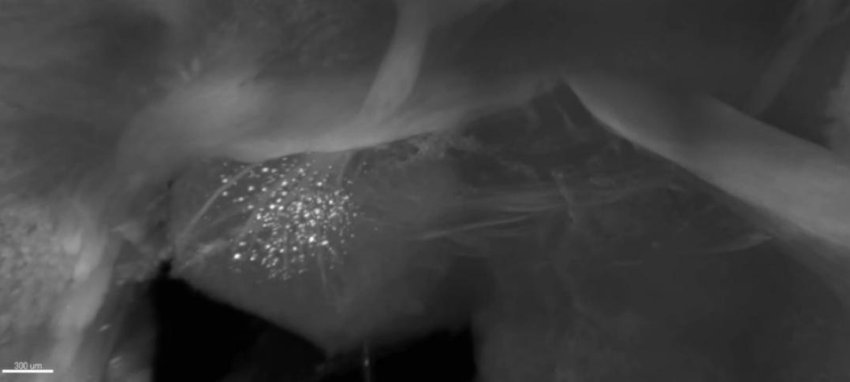
 Una scansione del cervello mostra un gruppo di piccoli punti bianchi che indicano placche amiloidi in una regione specifica. (Fonte: MIT)
Una scansione del cervello mostra un gruppo di piccoli punti bianchi che indicano placche amiloidi in una regione specifica. (Fonte: MIT)
La patologia di base del morbo di Alzheimer (MA), come le placche di amiloide, è ben avviata nel cervello già molto prima che siano visibili i sintomi, tipo la perdita di memoria. Un obiettivo di lunga data del settore è capire dove inizia tale patologia, in modo che da lì si possano iniziare gli interventi futuri.
Un nuovo studio di neuroscienziati del MIT potrebbe aiutare questi sforzi, avendo individuato le regioni dove compare inizialmente l'amiloide nel cervello di topi modello della malattia. In particolare, lo studio mostra anche che il grado di accumulo di amiloide in una di quelle stesse regioni del cervello umano è strettamente correlato con la progressione della malattia.
“L'Alzheimer è una malattia neurodegenerativa, perciò alla fine ci sarà una grande perdita di neuroni”, ha detto Wen-Chin 'Brian' Huang, co-autore dello studio e post-dottorato nel laboratorio del co-autore senior Li-Huei Tsai, professore di neuroscienze e direttore dell'Istituto Picower. “A quel punto sarebbe difficile curare i sintomi. È davvero fondamentale capire quali circuiti e regioni mostrano una disfunzione neuronale nelle prime fasi della malattia. Ciò a sua volta può facilitare lo sviluppo di terapie efficaci“.
La marcia dell'amiloide nel topo di Alzheimer - A partire da un momento precoce della vita di un topo modello di Alzheimer (5XFAD), i ricercatori sono riusciti a vedere accumuli di placca amiloide (bianco) nelle prime fasi della malattia in regioni profonde del cervello. Nei mesi successivi, le placche si sono diffuse da lì lungo circuiti specifici. A ogni nuova età il video ricomincia dal corpo mammillare.
Monitorare le placche
Molti gruppi di ricerca hanno fatto progressi negli ultimi anni, tracciando il percorso dell'amiloide nel cervello con tecnologie come la tomografia ad emissione di positroni (PET) e analizzando i cervelli post mortem, ma il nuovo studio pubblicato su Communication Biology aggiunge nuove prove sostanziali dal topo modello 5XFAD, perché i ricercatori hanno osservato in modo imparziale tutto il cervello fin dal primo mese di età.
Lo studio rivela che l'amiloide inizia la sua tremenda marcia in regioni cerebrali profonde come i corpi mammillari, il septum laterale e il subicolo, prima di farsi strada lungo specifici circuiti cerebrali che infine portano all'ippocampo, una regione chiave per la memoria, e alla corteccia, una regione cruciale per la cognizione.
Il team ha utilizzato la SWITCH, una tecnologia sviluppata da Chung, per etichettare le placche amiloidi e illuminare l'intero cervello dei topi 5XFAD in modo che potessero essere visibili in dettaglio fine in età diverse. Il team è riuscito a vedere che le placche emergevano prima sempre nelle strutture cerebrali profonde e quindi le seguivano lungo i circuiti, come il circuito di memoria Papez, fin quando si erano diffuse in tutto il cervello a 6-12 mesi (la durata della vita di un topo è massimo 3 anni).
I risultati aiutano a cementare una comprensione che è più difficile da ottenere dal cervello umano, ha detto Huang, perché la dissezione post mortem non può facilmente considerare come la malattia si è sviluppata nel tempo e la PET non offre il tipo di risoluzione che il nuovo studio fornisce nei topi.
L'amiloide nel corpo mammillare umano - Dopo aver osservato nei topi che il corpo mammillare è un punto cruciale precoce per la nascita di placche amiloidi nell'Alzheimer, i ricercatori hanno confermato che la densità delle placche amiloidi aumenta nel corpo mammillare umano con l'aggravamento della malattia.
Convalide chiave
È importante sottolineare che il team ha convalidato direttamente nel tessuto umano quanto era stato predetto delle loro scoperte sul topo: se il corpo mammillare è davvero un posto dove emergono molto presto le placche amiloidi, allora la densità di queste placche dovrebbe aumentare in proporzione all'avanzamento della malattia.
In effetti, quando il team ha usato la tecnica SWITCH per esaminare i corpi mammillari di cervelli umani post mortem, in diversi stadi della malattia, hanno visto esattamente questo rapporto: più avanzata era la fase (della malattia), più erano dense le placche nel corpo mammillare.
“Questo suggerisce che le alterazioni del cervello umano nel MA sono simili a quelle del topo”, hanno scritto gli autori. “Perciò noi proponiamo che i depositi di amiloide-beta iniziano in strutture sottocorticali suscettibili e si diffondono verso reti di memoria e cognitive sempre più complesse con l'età”.
Il team ha anche effettuato esperimenti per determinare se l'accumulo di placche osservato era una conseguenza reale correlata alla malattia per i neuroni nelle regioni colpite. Una delle caratteristiche del MA è un circolo vizioso in cui amiloide rende troppo eccitabili i neuroni e la sovreccitazione fa sì che i neuroni producano più amiloide.
Il team ha misurato l'eccitabilità dei neuroni nel corpo mammillare dei topi 5XFAD e ha scoperto che erano più eccitabili rispetto ai topi altrimenti simili che non sono portatori del set 5XFAD di alterazioni genetiche.
Come anteprima di una strategia terapeutica potenziale futura, quando i ricercatori hanno usato un approccio genetico per silenziare i neuroni nel corpo mammillare di alcuni topi 5XFAD, lasciando i neuroni inalterati nei loro compagni, i topi con neuroni silenziati hanno prodotto meno amiloide.
Mentre i risultati dello studio contribuiscono a spiegare molto su come si diffonde l'amiloide nello spazio e nel tempo nel cervello, essi sollevano anche nuove domande, ha detto Huang: come riesce il corpo mammillare a influenzare la memoria e quali tipi di cellule sono più colpite lì?
“Questo studio stabilisce un palcoscenico per ulteriori indagini su come la disfunzione in queste regioni e circuiti del cervello contribuisce ai sintomi del MA”, ha detto.
Fonte: Picower Institute at MIT (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Rebecca Gail Canter, Wen-Chin Huang, Heejin Choi, Jun Wang, Lauren Ashley Watson, Christine G. Yao, Fatema Abdurrob, Stephanie M. Bousleiman, Jennie Z. Young, David A. Bennett, Ivana Delalle, Kwanghun Chung, Li-Huei Tsai. 3D mapping reveals network-specific amyloid progression and subcortical susceptibility in mice. Communications Biology, 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV