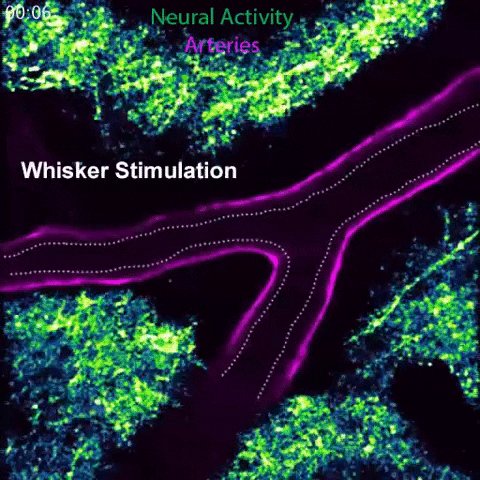
 Le arterie in un cervello di topo si dilatano in risposta all'attività neurale locale. Questo processo, noto come accoppiamento neurovascolare, è regolato da segnali diffusi dalle arterie (vedi animazione sotto).Il cervello è un organo famelico. Un cervello umano adulto di tre chili consuma circa un quinto dell'energia del corpo, eppure non può immagazzinare tale energia da solo e richiede nutrimento costante dal sistema cardiovascolare.
Le arterie in un cervello di topo si dilatano in risposta all'attività neurale locale. Questo processo, noto come accoppiamento neurovascolare, è regolato da segnali diffusi dalle arterie (vedi animazione sotto).Il cervello è un organo famelico. Un cervello umano adulto di tre chili consuma circa un quinto dell'energia del corpo, eppure non può immagazzinare tale energia da solo e richiede nutrimento costante dal sistema cardiovascolare.
Il fabbisogno energetico dell'organo varia notevolmente a seconda dell'attività neurale, e deve essere portata una quantità sufficiente di sangue al posto giusto, al momento giusto, proprio per garantire la funzione sana del cervello.
Per soddisfare queste richieste sempre mutevoli, un processo chiamato 'accoppiamento neurovascolare' aumenta rapidamente il flusso sanguigno nelle aree dove c'è aumento dell'attività neurale. Questo processo è ridotto in condizioni come ipertensione, diabete e Alzheimer, e serve anche come base per varie tecnologie di scansione come la fMRI (risonanza magnetica funzionale), che usa il flusso di sangue per visualizzare l'attività cerebrale.
Nonostante la sua importanza, non era finora chiaro come comunicano i vasi sanguigni del cervello per permettere l'accoppiamento neurovascolare. Ora, in uno studio pubblicato su Nature il 19 febbraio, i neuroscienziati della Harvard University riferiscono la scoperta di un meccanismo di controllo nel cervello dei topi che assicura un adeguato flusso di sangue alle aree con aumento dell'attività neurale, in modo rapido e preciso.
I loro esperimenti rivelano che le arterie cerebrali regolano attivamente l'accoppiamento neurovascolare in risposta all'attività neuronale, e che la proteina Mfsd2a, già conosciuta come regolatore chiave della barriera protettiva emato-encefalica, è fondamentale per questo processo. I risultati fanno luce su meccanismi che aprono nuovi percorsi di studio sul ruolo dell'accoppiamento neurovascolare nelle malattie neurologiche.
“Ora abbiamo un'idea ferma sui meccanismi coinvolti nell'accoppiamento neurovascolare, compresi i suoi componenti molecolari, cellulari e subcellulari, che non abbiamo mai avuto prima”, ha detto l'autrice senior dello studio Chenghua Gu, professoressa di neurobiologia all'Istituto Blavatnik di Harvard e studiosa dell'Howard Hughes Medical Institute. “Questo ci mette in grado di sezionare questo processo e determinare, per esempio, se i deterioramenti dell'accoppiamento neurovascolare che vediamo in malattie come l'Alzheimer sono il risultato o la causa della patologia”.
Solleticare i baffi
In studi precedenti, la Gu e i colleghi avevano dimostrato che l'integrità protettiva della barriera ematoencefalica è assicurata dalla proteina Mfsd2a, che sopprime la formazione di caveole (piccole bolle di lipidi che contengono molecole di segnalazione) dai capillari nel cervello dei topi.
Con loro grande sorpresa, hanno scoperto che le arterie che portano il sangue ricco di sostanze nutritive dai polmoni, e rappresentano circa il 5% dei vasi sanguigni nel cervello, aveva le caratteristiche opposte ai capillari. Alle arterie mancava la Mfsd2a ed esibivano elevate quantità di caveole.
Nel corso dello studio, il team ha esaminato questa discrepanza. Guidati dai primi autori Brian Chow e Vicente Nunez, i ricercatori hanno stimolato i baffi di topi sani e svegli, e hanno guardato contemporaneamente l'attività cerebrale degli animali con una tecnica potente chiamata microscopia a 2 fotoni.
In risposta alla stimolazione dei baffi, i topi normali dimostrano un aumento dell'attività neurale, del diametro arterioso e del flusso sanguigno nella corrispondente area sensoriale del cervello. Tuttavia, i topi geneticamente progettati per mancare delle caveole avevano la stessa attività neuronale ma una riduzione significativa del flusso sanguigno e della dilatazione arteriosa, indicando un deficit nell'accoppiamento neurovascolare.
Il gruppo ha impedito specificamente alle cellule endoteliali che compongono il rivestimento delle arterie di formare caveole, forzando queste cellule ad esprimere la Mfsd2a normalmente assente. Questo ha di nuovo indotto alterazioni significative nell'accoppiamento neurovascolare, dimostrando l'importanza delle caveole nelle arterie.
Ulteriori esperimenti hanno dimostrato il ruolo unico delle cellule endoteliali arteriose. Si sapeva da prima che l'attività neurale rilassa le cellule muscolari lisce che circondano le arterie, fatto che porta alla vasodilatazione e all'aumento del flusso sanguigno. Al contrario, i risultati dello studio hanno rivelato un meccanismo diverso in cui le caveole nelle cellule endoteliali arteriose consentono l'accoppiamento neurovascolare collegando il segnale di rilassamento dai neuroni alle cellule muscolari lisce.
“Da oltre un secolo, sappiamo che esiste questo fenomeno, dove l'attività neurale aumenta rapidamente il flusso di sangue in modo molto locale e temporalmente preciso”, ha detto la Chow. “Ma i meccanismi della comunicazione tra il sistema nervoso a quello vascolare per coordinare questo evento erano in gran parte sconosciuti, ed è stato estremamente sorprendente scoprire che le cellule endoteliali delle arterie hanno un ruolo attivo nel processo”.
Consumo di precisione
Il team ha anche scoperto che le caveole funzionano in modo indipendente dalla segnalazione dell'ossido nitrico, un percorso sistemico importante che regola la dilatazione dei vasi sanguigni, notoriamente puntato dai farmaci come la nitroglicerina per l'insufficienza cardiaca o il sildenafil (Viagra) per la disfunzione erettile.
Quando sia le caveole che la segnalazione dell'ossido nitrico sono stati bloccati, il gruppo ha visto una completa assenza di accoppiamento neurovascolare. Ciascun meccanismo sembra avere un ruolo ugualmente importante, ma indipendente, nella regolazione del flusso sanguigno in risposta all'attività neurale.
Secondo gli autori, questa scoperta suggerisce che le caveole nelle arterie possono essere responsabili di aumenti mirati più precisamente nel flusso sanguigno, mentre l'ossido nitrico agisce più in generale.
La Gu e i colleghi stanno ora studiando l'esatta composizione delle molecole di segnalazione contenute nelle caveole per capire meglio questo processo. I ricercatori hanno detto che sperano che le basi meccanicistiche appena rivelate dell'accoppiamento neurovascolare permettano nuovi approcci sperimentali per studiare la biologia di questo processo e come va storto nelle malattie.
La Gu ha detto:
“Abbiamo stabilito un set molto potente di strumenti genetici che ci permettono non solo di identificare, ma anche di manipolare i meccanismi molecolari alla base dell'accoppiamento neurovascolare. Questo è importante, visto che molti aspetti dell'accoppiamento neurovascolare non sono ancora chiari”.
“Per esempio, anche se l'aumento di afflusso di sangue locale è deteriorato, il cervello riceve comunque sangue e ossigeno. Qual è l'impatto di questo sui neuroni? In che modo influisce sulle funzioni del cervello? E contribuisce a condizioni come la demenza neurovascolare?
"Siamo ora in grado di mettere in pratica una scienza rigorosa che potrebbe consentirci di rispondere a domande come queste”.
Fonte:Kevin Jiang in Harvard Medical School (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Brian W. Chow, Vicente Nuñez, Luke Kaplan, Adam J. Granger, Karina Bistrong, Hannah L. Zucker, Payal Kumar, Bernardo L. Sabatini, Chenghua Gu. Caveolae in CNS arterioles mediate neurovascular coupling. Nature, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV