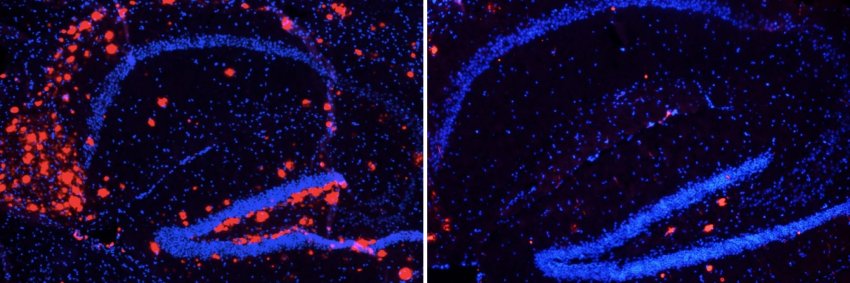
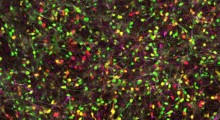
 Placche di amiloide-beta (rosso) nel cervello, in caso di carenza di LANDO (sinistra) o con LANDO normale (destra).
Placche di amiloide-beta (rosso) nel cervello, in caso di carenza di LANDO (sinistra) o con LANDO normale (destra).
Scienziati del St. Jude Children’s Research Hospital di Memphis, nel Tennessee, hanno fatto un passo avanti nella comprensione di un trattamento potenziale del morbo di Alzheimer (MA). Il lavoro si concentra sulla 'endocitosi associata a LC3' (LANDO, LC3-associated endocytosis) e sul suo ruolo nella neuroinfiammazione. I risultati sono pubblicati online su Science Advances.
I ricercatori avevano scoperto in precedenza il percorso LANDO nelle cellule microgliali, le principali cellule immunitarie del cervello e del sistema nervoso centrale. Gli scienziati hanno scoperto che, quando vengono eliminati i geni richiesti per questo percorso, la progressione del MA accelera in un topo modello della malattia. I ricercatori hanno anche dimostrato che LANDO protegge dalla neuroinfiammazione, una delle caratteristiche del MA.
Continuando a indagare su LANDO, i ricercatori hanno identificato una nuova funzione della proteina ATG16L. Questa proteina è fondamentale per l'autofagia, il processo normale mediante il quale una cellula ricicla i suoi componenti durante i periodi di stress o di privazione di energia. Mentre ATG16L è importante per l'autofagia, può anche avere un ruolo nel LANDO. I ricercatori hanno riscontrato che, se si elimina una regione dell'ATG16L chiamata 'dominio WD', il Lando risulta inibito mentre l'autofagia continua.
“Abbiamo incontrato questo percorso nel contesto della ricerca sul tumore al cervello, ma ha importanti implicazioni per le malattie neuroinfiammatorie e neurodegenerative”, ha detto l'autore senior Douglas Green PhD, preside del Dipartimento di Immunologia al St. Jude. “Abbiamo dimostrato che la carenza di LANDO, combinata con l'invecchiamento, può portare al MA in un topo modello unico, e ci sono evidenze che suggeriscono che questo potrebbe succedere anche negli esseri umani”.
Un modello per la ricerca sul MA
La maggior parte dei topi modello usati nella ricerca sul MA si affidano ai cambiamenti genetici per ricreare la malattia. Per questo lavoro, i ricercatori hanno usato un nuovo modello, con una carenza specifica solo del dominio WD di ATG16L. Questo significa che il modello esegue l'autofagia normalmente, ma manca del percorso LANDO.
Quando i topi hanno 2 anni di età, mostrano sintomi e patologie che mimano il MA umano. Questo modello spontaneo di MA associato all'età è il primo creato cancellando un singolo dominio di proteine (WD su ATG16L), non associato in precedenza al MA.
I ricercatori hanno anche analizzato campioni di tessuto umano di MA, osservando che l'espressione delle proteine che regolano il LANDO, compresa l'ATG16L, è diminuita di oltre il 50% nelle persone con MA. Questa scoperta mostra una correlazione nel modo in cui il deficit di LANDO, combinato con l'invecchiamento, può portare al MA nel topo modello e nell'uomo.
Emerge una strategia di trattamento
La riduzione della neuroinfiammazione è stata proposta come un modo potenziale per curare il MA. Per trattare il loro nuovo topo modello, i ricercatori hanno usato un composto che inibisce l'inflammasoma, un complesso di proteine che attiva le reazioni immunitarie pro-infiammatorie.
Gli scienziati hanno puntato l'inflammasoma responsabile della neuroinfiammazione nelle persone con MA. I ricercatori hanno profilato il comportamento del modello e hanno trovato le prove di una migliore conoscenza e memoria, oltre a una diminuzione della neuroinfiammazione.
“Questo lavoro solidifica l'«endocitosi associata a LC3» come un percorso che impedisce l'infiammazione e la produzione di citochine infiammatorie nel sistema nervoso centrale”, ha detto il primo autore Bradlee Heckmann PhD, immunologo del St. Jude. “Mentre gran parte dei dati sul LANDO suggeriscono un ruolo significativo nelle malattie neuroinfiammatorie e neurodegenerative, c'è una forte possibilità che possa anche essere puntato come terapia contro il cancro o per le malattie infettive che si basano su processi simili per sopravvivere”.
Fonte: St. Jude Children's Research Hospital (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Bradlee Heckmann, Brett Teubner, Emilio Boada-Romero, Bart Tummers, Clifford Guy, Patrick Fitzgerald, Ulrike Mayer, Simon Carding, Stanislav Zakharenko, Thomas Wileman, Douglas Green. Noncanonical function of an autophagy protein prevents spontaneous Alzheimer’s disease. Science Advances, 14 Aug 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.



 Associazione Alzheimer OdV
Associazione Alzheimer OdV