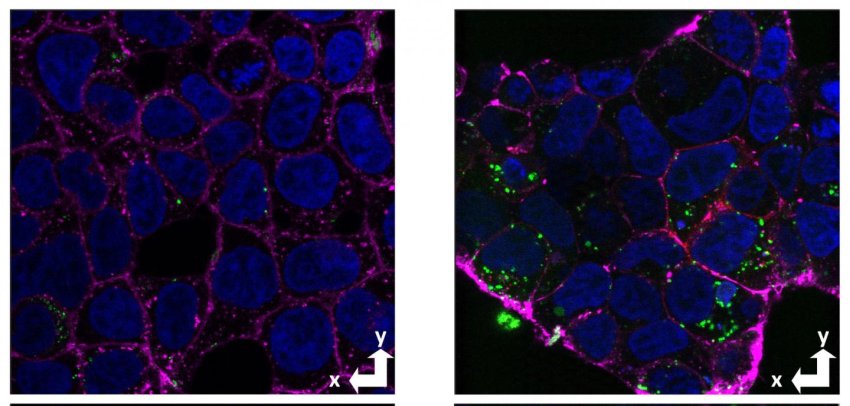
 Immagini al microscopio confocale di cellule con e senza la proteina prionica cellulare (rosso), che mostrano un aumento dell'assorbimento di amiloide-beta (verde) nelle cellule con la proteina prionica (destra) rispetto alle cellule prive della proteina prionica (sinistra). In magenta la membrana e in blu il nucleo. Fonte: Graham Roseman, UCSC
Immagini al microscopio confocale di cellule con e senza la proteina prionica cellulare (rosso), che mostrano un aumento dell'assorbimento di amiloide-beta (verde) nelle cellule con la proteina prionica (destra) rispetto alle cellule prive della proteina prionica (sinistra). In magenta la membrana e in blu il nucleo. Fonte: Graham Roseman, UCSC
Una delle caratteristiche del morbo di Alzheimer (MA) è la formazione di grumi amiloidi, placche appiccicose della proteina amiloide-beta (Aβ), che si raccolgono tra i neuroni nel cervello. Sempre più spesso, tuttavia, l'attenzione si sposta da queste placche insolubili alle forme solubili di Aβ che possono essere prese dentro dei neuroni e sono altamente neurotossiche.
Un nuovo studio di ricercatori della University of California di Santa Cruz ha individuato un segmento della proteina Aβ che è riconosciuto dai recettori coinvolti nella captazione neuronale di questo peptide tossico. I ricercatori hanno usato un nuovo approccio per studiare i meccanismi di assorbimento cellulare dell'Aβ e, nella pubblicazione del 2 novembre su PNAS, suggeriscono che puntare questo processo può essere un approccio promettente per lo sviluppo di farmaci di MA.
“Ci sono molti modi diversi con cui l'Aβ può essere tossica all'interno delle cellule, quindi non sarebbe bello se potessimo bloccare il suo assorbimento da parte dei neuroni? Si tratta di un percorso che possiamo puntare“, ha detto l'autore senior Jevgenij Raskatov, assistente professore di chimica e biochimica alla UC Santa Cruz.
Nel nuovo studio, Raskatov ha collaborato con il coautore senior Glenn Millhauser, professore illustre di chimica e biochimica della UCSC, per studiare le interazioni tra Aβ e la proteina prionica cellulare. Il laboratorio di Millhauser studia la struttura e le funzioni della proteina prionica, una proteina di membrana presente sulle superfici di vari tipi di cellule, compresi i neuroni nel cervello.
Studi precedenti di altri ricercatori avevano indicato che la proteina prionica cellulare normale (non la variante anomala che causa le malattie da prioni) si lega ai grumi di Aβ ed è coinvolta nell'assorbimento e nella neurotossicità. I ricercatori della UCSC, guidati dal dottorando Alejandro Foley e dal ricercatore postdottorato Graham Roseman, hanno cercato di verificare se la proteina prione funge anche da recettore per assorbire forme solubili di Aβ, e identificare il sito all'interno dell'Aβ che si lega a questo recettore.
Immagini speculari
I ricercatori hanno seguito un approccio basato sul lavoro precedente del laboratorio del Raskatov, usando le versioni speculari dell'Aβ per mostrare che la captazione cellulare è per lo più mediata dai recettori sulla superficie delle cellule. Nel precedente lavoro, i ricercatori avevano confrontato l'assorbimento di Aβ naturale con una versione sintetica in cui la disposizione degli atomi negli aminoacidi della proteina è l'immagine speculare della disposizione naturale.
Questo aggiustamento modifica lievemente la struttura della proteina in modi che potrebbero interferire con il suo legame ad un recettore, quindi la scoperta che l'assorbimento cellulare della versione speculare era notevolmente ridotto, ha indicato la captazione mediata dal recettore.
L'Aβ può essere di diverse lunghezze, ma la variante più tossica è lunga 42 aminoacidi. Per isolare il sito coinvolto nel legamento del recettore, i ricercatori hanno creato una libreria di segmenti peptidici di Aβ composta solo da amminoacidi da 1 a 16 o da 1 a 30, per esempio. Per ogni segmento, hanno prodotto una versione con aminoacidi naturali ('L stereoisomero') ed una con amminoacidi speculari ('D stereoisomero').
Dopo aver testato tutti i peptidi nella libreria per l'assorbimento cellulare, hanno scoperto che gli amminoacidi 1-30 hanno la stessa stereoselettività dell'Aβ a lunghezza piena, con maggiore assorbimento della forma L rispetto alla D. Inoltre, questo segmento è completamente solubile e non forma aggregati perché manca il lungo dominio idrofobico coinvolto nella aggregazione di Aβ in grumi e fibrille.
“Con questa Aβ accorciata, possiamo disaccoppiare l'assorbimento cellulare dell'aggregazione, che ci dà un grande modello per studiare l'assorbimento”, ha detto Raskatov.
Valutando assorbimento di Aβ nelle cellule con e senza la proteina prionica, i ricercatori hanno dimostrato per la prima volta il ruolo della proteina prionica nell'assorbimento cellulare di Aβ solubile, coerente con la sua selettività per il 'L.stereoisomero' dell'Aβ.
Il segmento non-aggregante 1-30 dell'Aβ ha mostrato assorbimento prione-dipendente e stereoselettività identici. I ricercatori hanno usato anche la spettroscopia a risonanza magnetica nucleare per raccogliere informazioni dettagliate sulle interazioni coinvolte nel legame dell'Aβ alla proteina prionica cellulare.
Oligomeri
I loro risultati mostrano che il legame dell'Aβ sulla superficie cellulare, che porta alla sua interiorizzazione, è in gran parte causato dalla sequenza di amminoacidi 1-30 e non dallo stato dell'aggregazione. Quando le molecole di Aβ cominciano a aggregarsi, formano 'oligomeri' costituiti da un piccolo numero di molecole incollate tra loro, che sono ancora solubili e possono essere inglobate dai neuroni.
Questi oligomeri solubili sono sempre più considerati come la forma di Aβ che innesca i processi patologici che portano al MA, ma ci sono molte forme aggregate diverse.
“Ci sono diversi livelli di aggregazione, diverse dimensioni e tipi di oligomeri, e una grande domanda è stata quali forme vengono interiorizzate e causano neurotossicità”, ha detto Raskatov. “I nostri risultati suggeriscono che qualsiasi forma in cui è esposta quella sequenza di aminoacidi si legherà alla proteina prionica”.
Secondo Millhauser, “I passi iniziali che portano al MA possono essere il trasporto mediato dalla proteina prionica di Aβ solubile nei neuroni, dove si raggruma, formando aggregati tossici che infine portano alle placche caratteristiche associate alla malattia”.
Anche se la proteina prionica sembra essere responsabile della maggior parte dell'assorbimento di Aβ, lo studio suggerisce che altri recettori possono offrire percorsi alternativi. Tuttavia, i farmaci che puntano il segmento 1-30 dell'Aβ o i siti a cui si lega sui recettori, possono possedere il potenziale terapeutico per trattare il MA.
“I nostri risultati aprono nuove possibilità per comprendere il MA e suggeriscono promettenti strategie per una terapia”, ha detto Millhauser.
Fonte: Tim Stephens in University of California Santa Cruz (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Alejandro Foley, Graham Roseman, Ka Chan, Amanda Smart, Thomas Finn, Kevin Yang, Scott Lokey, Glenn Millhauser, Jevgenij Raskatov. Evidence for aggregation-independent, PrPC-mediated Aβ cellular internalization. PNAS, 2 Nov 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV