Recenti esperimenti nei topi hanno rafforzato l'idea che l'Alzheimer sia guidato da una diffusione di tipo infettivo di aggregati proteici nel cervello.
Anche se può sembrare sorprendente, questa ipotesi era popolare tra i ricercatori di Alzheimer negli anni passati (vedi "Proteina di Alzheimer mostra contagiosità di tipo Prione").
In realtà, rappresenta un ritorno ad una delle prime teorie moderne sull'Alzheimer: che sia una malattia da prioni a trasmissibilità debole. "C'è stato un ritorno a questo tipo di pensiero, perché ora c'è la prova reale della potenziale trasmissibilità dell'Alzheimer", afferma Thomas Wisniewski, ricercatore di Alzheimer e prioni alla School of Medicine della New York University. "In effetti, questa capacità di trasmettere una conformazione anormale è probabilmente una proprietà universale dell'amiloide che forma le proteine".
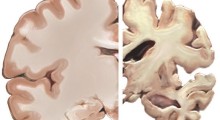
Negli anni '70 e all'inizio degli '80, i ricercatori hanno osservato analogie fondamentali tra l'Alzheimer e le encefalopatie spongiformi trasmissibili (TSE), come la scrapie e la malattia di Creutzfeldt-Jakob. Entrambi i tipi di malattia lasciano alle spalle depositi fibrosi, contenenti proteine, chiamati amiloidi, per le strutture molecolari comuni che contengono. Nell'Alzheimer, i ricercatori sapevano di due amiloidi principali: una "placca amiloide" arrotondata fuori delle cellule e i grovigli "neurofibrillari" all'interno delle cellule. Inoltre, le TSE creano un modello spugnoso di fori nel cervello, e questo patologia "spongiforme" è stata vista, seppure in misura molto minore, nel cervello di alcune persone affette da Alzheimer.
In quel momento, molti pensavano che le TSE sono causate da "virus lenti". Tuttavia, JS Griffith, Carlton Gajdusek, Stanley Prusiner ed altri hanno proposto che le TSE potrebbero essere "infezioni" non di virus o batteri o altri microbi, ma di strutture auto-replicanti fatte soltanto di proteina. Gajdusek le ha definite "amiloidi infettive", ma il termine "prione ", introdotto da Prusiner (anch'egli affiliato a Dana Alliance) nel 1982, è rimasto fermo: "Poiché le nuove proprietà dell'agente della scrapie lo distinguono dai virus, dai plasmidi e dai viroidi, un nuovo termine "prioni" si propone per indicare una piccola particella infettiva proteica che è resistente alla maggior parte delle procedure di inattivazione che modificano gli acidi nucleici [cioè, DNA o RNA]. Conoscere la struttura dell'agente della scrapie può avere un senso per comprendere le cause di molte malattie degenerative.
Le TSE potrebbero essere trasmesse in modo riproducibile, ad esempio iniettando materia cerebrale da un ovino infetto nel cervello di una pecora sana. Ma Gajdusek ha tentato esperimenti simili con estratti di cervello di Alzheimer e scimpanzé, e ha riferito nel 1980 che non c'era una trasmissione affidabile della malattia. Poi, nel 1984, George Glenner e CW Wong, e nell'anno seguente, Colin Masters e Konrad Beyreuther, hanno isolato la placca proteica di Alzheimer. Essi hanno osservato che era una proteina diversa, molto inferiore a quella isolata dalle amiloidi della scrapie. Nel momento in cui i ricercatori di TSE e di Alzheimer si sono concentrati sullo studio di queste proteine separate, le teorie per i due tipi di malattie hanno cominciato a divergere, e l '"ipotesi prione" per l'Alzheimer è stata in gran parte dimenticata.
Dagli '80 ai '90: placche causano l'Alzheimer
Masters e Beyreuther hanno prodotto anticorpi per le proteine della placca di Alzheimer, che è stata poi chiamata beta amiloide (A-beta). Con questi anticorpi sono stati in grado di etichettare le placche nei cervelli sottoposti ad autopsia in modo molto più sensibile di quanto i patologi avevano potuto fare usando i marcatori tradizionali per l'amiloide. Nel 1988 hanno riferito che le placche di A-beta erano comuni e diffuse nei campioni di cervello di persone anziane, e depositi meno densi di A-beta erano ancora rilevabili tra alcune persone neurologicamente sane di mezza età. Quindi era chiaro che l'Alzheimer è caratterizzato da una lenta accumulazione di placche di A-beta in tutto il cervello, mentre i sintomi compaiono solo negli ultimi dieci anni della malattia.
Beyreuther e colleghi hanno anche scoperto che la proteina A-beta è un frammento (quanto rimane dopo un taglio da enzimi) di una proteina molto più grande di membrana neuronale (chiamata "proteina precursore amiloide," o APP ), e che l'APP è codificata da un gene sul cromosoma 21. Sapevano che le persone con sindrome di Down producono copie in eccesso di APP insieme ad altre proteine del cromosoma 21; e hanno depositi di placca A-beta di tipo Alzheimer nei loro cervelli a partire dai 30 anni, e spesso soffrono di una forma di demenza precoce. Questo ancora una volta ha fatto capire che l'A-beta è l'agente tossico che causa l'Alzheimer.
Nei primi anni 1990, nuovi rapporti sembravano confermare questo sospetto. L'A-beta sembrava tossico per i neuroni nelle piastrine di laboratorio. Nelle famiglie con insorgenza precoce di Alzheimer sono state trovate mutazioni di APP. E i topi che sono stati geneticamente modificati per produrre APP in eccesso, hanno sviluppato l'Alzheimer come patologia cerebrale. La ricerca di Alzheimer oggi irrompe nella coscienza pubblica come mai prima, insieme con la speranza che la malattia possa essere presto curata.
Primi '90 a primi 2000: Confusione e dibattito
La maggior parte dei modelli di topi che sovraesprimevano l'APP, creati nei primi anni '90, sviluppavano placche, ma non sviluppavano l'altro amiloide importante dell'Alzheimer, i grovigli neurofibrillari, che sono fatti di proteine tau e appaiono all'interno dei neuroni colpiti. Questi "topi di Alzheimer" non sono nemmeno riusciti a dimostrare le profonde perdite neuronali e le defaillances di memoria osservate nei pazienti umani di Alzheimer. L'unica eccezione, riportata su Nature alla fine del 1991, è stata ritirata all'inizio del 1992 essendo provato che era fraudolenta.
La maggior parte delle famiglie con mutazioni di APP non evidenziano iperespressione dell'A-beta (come era stato pensato inizialmente) ma sovraesprimono una versione relativamente rara, prone-aggregata, nota come A-beta-42. I primi rapporti che l'A-beta è tossica per i neuroni erano anche difficili da riprodurre; successivi esperimenti hanno suggerito che la proteina diventa tossica solo quando le condizioni delle piastrine del laboratorio permettono di avviare la formazione di aggregati. Tuttavia, gli aggregati finali nelle placche purificate mostravano una tossicità molto debole per i neuroni, ammesso che fossero tossici.
Anche gli studi autoptici nel 1990 mettevano in dubbio l'ipotesi A-beta. Hanno scoperto che la maggior parte del materiale della placca A-beta appare nel cervello ben prima della comparsa della demenza. I grovigli di tau si correlano meglio con la demenza, e si diffondono nel cervello in un "modello di distribuzione che permette la differenziazione di sei tappe", hanno scritto i neuropatologi Heiko ed Eva Braak nel 1991.
Molti ricercatori vedevano ancora le placche come causa precoce della malattia, e così le placche sono state l'obiettivo dei primi trattamenti sperimentali mirati a bloccare l'Alzheimer. Tuttavia questi trattamenti hanno funzionato male, se addirittura non funzionato del tutto. Anche un vaccino attivo per A-beta per ridurre fortemente le placche nel cervello dei pazienti non è stato in grado di rallentare il peggioramento della demenza.
Le placche A-beta erano il bersaglio sbagliato? Erano i grovigli tau i veri colpevoli? Oppure erano entrambe "aringhe rosse", il bersaglio sbagliato?
Nei primi esperimenti con l'A-beta, Beyreuther e altri avevano trovato prove che la proteina, oltre a formare lunghi aggregati di fibrille, fonte della placca, può raggrupparsi in piccoli oligomeri solubili " formati da relativamente poche copie di A-beta. Gli scienziati hanno sospettato che questi oligomeri esistono solo di sfuggita, come aggregati intermedi nel percorso da "monomeri" copia singola alle lunghe fibrille "polimero" . Gli oligomeri sono stati anche molto difficili da studiare negli esperimenti, perché erano biochimicamente indistinguibili da monomeri e fibrille. Così sono stati largamente ignorati.
Poi, nel 1998, William Klein della Northwestern University ha dimostrato che l'A-beta, quando è costretto a rimanere in forma di oligomero, danneggia immediatamente le sinapsi neuronali e alla fine uccide i neuroni, anche se non lo fanno le fibrille di A-beta. Nel corso degli anni 2000, si sono accumulate prove che gli oligomeri sono le uniche forme veramente tossiche di A-beta, non solo nel piatto di laboratorio, ma nei modelli animali. I ricercatori hanno anche trovato prove che altri amiloidi che formano le proteine, come la tau, la proteina alfa sinucleina correlata al Parkinson, la proteina huntingtina correlata alla corea di Huntington, e anche la proteina PrP coinvolta nelle malattie da prioni, sono tossici per i neuroni principalmente come oligomeri, non come grandi fibrille amiloidi.
Questi oligomeri sembrano condividere una struttura comune, o "conformazione", che li rende in qualche modo tossici. Un certo numero di laboratori tra cui quello di Charles Glabe, all'Università di California-Irvine, hanno prodotto anticorpi specifici per la conformazione in grado di riconoscere gli oligomeri tossici di molte di queste proteine nonostante le loro molto diverse sequenze di amino-acidi. Glabe e altri hanno anche trovato le prove che gli oligomeri più tossici possono essere quelli che esistono in forme stabili tipo anello, e non diventeranno fibrille.
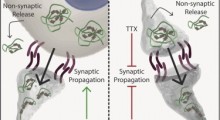
L'idea che gli oligomeri sono gli aggregati tossici sia nell'Alzheimer che nelle malattie da prione ha contribuito a riunire i due campi di ricerca.C'è stata anche l'accettazione della probabilità che l'Alzheimer ha una vera e propria trasmissibilità, seppur debole, di tipo prionica. Matthias Jucker dell'Università di Tubinga ha mostrato nel 2006 e nel 2010 che la patologia di Alzheimer, in effetti può essere trasmessa ai topi iniettando estratti di cervello di Alzheimer nel loro cervello o negli organi.
Nessuno sa perché gli aggregati A-beta sembrano cos'ì meno trasmissibili rispetto agli aggregati di PrP nelle malattie da prioni. Alcuni scienziati suggeriscono, per esempio, che l'aggregazione PrP può essere accelerata da interazioni nelle membrane cellulari che non si verificano per l'A-beta. "E' una ipotesi, a questo punto", dice Wisniewski.
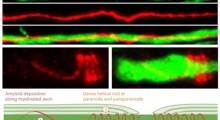
In ogni caso, nel corso degli ultimi anni, altri sperimentatori hanno trovato prove che tutti gli aggregati di tau (huntingtina, alfa-sinucleina, e la proteina superossido dismutasi 1 associata alla malattia di Gehrig Lou) possono diffondersi in modilità di tipo prionica, da cellula a cellula, nel piatto in laboratorio o nel cervello di topi. In recenti studi clinici di trapianto neuronale, aggregati di alfa-sinucleina sembrano diffondersi dal cervello di pazienti di Parkinson nei neuroni sani trapiantati.
C'è anche la prova, che aggregati di una di queste proteine possono agire come semi o modelli che avviano l'aggregazione di altri. Alcuni ricercatori suggeriscono che questa semina incrociata a volte può essere un innesco o un accelerante di malattie neurodegenerative. Certamente per l'Alzheimer, ci sono da tempo prove circostanziali che l'accumulo di aggregazione di A-beta nel corso di decenni innesca alla fine l'aggregazione della tau, che rappresenta l'ultimo stadio della malattia letale. Ci sono inoltre alcune evidenze sperimentali, che oligomeri A-beta possono indurre direttamente la formazione di oligomero tau nel piatto di laboratorio. Dennis Selkoe della Harvard Medical School (anch'esso membro di Dana Alliance) ha dimostrato l'anno scorso che oligomeri A-beta raccolti dal cervello umano di Alzheimer possono attivare la formazione e la diffusione di grovigli tau nei neuroni in coltura.
Come questi oligomeri danneggiano le sinapsi e uccidono i neuroni, e perché alcune proteine oligomeriche uccidono alcuni tipi di neuroni e non altri, sono tra le principali domande senza risposta. Un'altra questione irrisolta è se gli oligomeri iniziali sorgono sempre spontaneamente all'interno del cervello, o, talvolta provengono in modo contagioso dall'esterno (vedi "Il morbo di Parkinson inizia fuori del cervello? ").
I ricercatori vogliono anche conoscere meglio le dinamiche dell'auto-propagazione di fibrille e oligomeri all'interno dei tessuti. Ma anche prima di conoscere le risposte dettagliate a queste domande, i ricercatori hanno stabilito le strategie di trattamento di base: la maggior parte cerca di aumentare i sistemi del cervello che riducono naturalmente gli aggregati tossici, o di fornire gli anticorpi o altri agenti che rimuovono direttamente gli aggregati tossici. "Idealmente, si vorrebbe puntare alle strutture oligomeriche anormali", dice Wisniewski.
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti sotto per dire la tua opinione. Che è importante e unica.
Pubblicato da Jim Schnabel su Dana Foundation il 17 Febbraio 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X.
I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare a informarti. Clicca qui a destra: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV