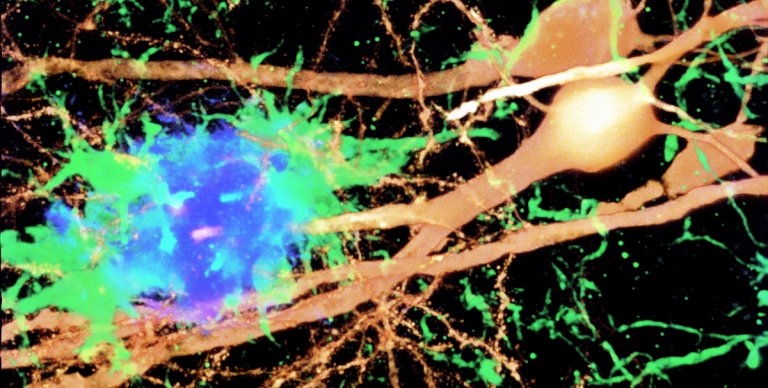
 Le microglia (verde) si attivano in risposta a determinati tipi di placche amiloidi tossiche (blu) e danneggiano i neuroni (oro), portando a difetti nell'apprendimento e nella memoria. Fonte: Ethan Roy / Hui Zheng
Le microglia (verde) si attivano in risposta a determinati tipi di placche amiloidi tossiche (blu) e danneggiano i neuroni (oro), portando a difetti nell'apprendimento e nella memoria. Fonte: Ethan Roy / Hui Zheng
Quando l'immunologa Dott.ssa Wei Cao è entrata al Baylor College of Medicine tre anni e mezzo fa, il suo primo progetto è stato studiare come l'infiammazione contribuisce al morbo di Alzheimer (MA).
“Il MA è la causa più comune di demenza negli anziani. Quello che si capisce al momento è che, oltre ad avere placche di amiloide-beta e grovigli di proteine tau, il cervello dei pazienti con questa condizione ha una risposta infiammatoria marcata, e che questa infiammazione potrebbe essere un problema maggiore della stessa aggregazione della proteina“, ha detto la Cao, professoressa associata di genetica molecolare e umana al Baylor.
L'infiammazione nel MA comporta l'attivazione dei due tipi di cellule del cervello: le cellule immunitarie residenti chiamate microglia, e gli astrociti, cellule a forma di stella che supportano le funzioni dei neuroni. In aggiunta, ci sono livelli elevati di citochine, molecole che sono prodotte dalle cellule immunitarie per promuovere l'infiammazione. Ma la domanda rimane: come fa l'infiammazione cronica nel cervello con MA a portare alla disfunzione neuronale e alla conseguente neurodegenerazione e demenza?
Zoomare nel cervello
Le placche amiloidi nel cervello delle persone con MA hanno una composizione eterogenea; per esempio, alcune possono anche contenere zuccheri, lipidi o acidi nucleici. In precedenza, la Cao e i suoi colleghi avevano scoperto che le fibrille amiloidi con acidi nucleici, ma non quelle senza di loro, inducono le cellule immunitarie nel sangue a produrre 'interferone di tipo 1' (IFN).
L'IFN è una citochina potente prodotta quando le cellule immunitarie percepiscono acidi nucleici, come quelli che provengono dalle particelle virali, nel loro ambiente. L'IFN innesca una risposta infiammatoria benefica che è la prima linea di difesa contro le infezioni virali.
“Anche se è più conosciuta per la sua capacità di indurre uno stato antivirale nelle cellule, l'IFN è coinvolta anche nella modulazione immunitaria e nel danno tissutale associato alle condizioni infettive, autoimmuni e altre. Ma, fino ad ora, l'IFN non è stato implicato esplicitamente nel MA“, ha detto la Cao.
“In questo progetto, ci siamo concentrati su quello che succede nel cervello con MA”, ha detto il dott. Ethan R. Roy, dottorando di Biologia Traslazionale e Medicina Molecolare al Baylor mentre stava lavorando su questo progetto. “Abbiamo iniziato indagando se le microglia del cervello sono in grado di rispondere alla combinazione amiloide/acido nucleico producendo IFN”.
Roy ha esaminato diversi topi modelli di MA nel laboratorio della dott.ssa Hui Zheng, professoressa di genetica molecolare ed umana e direttrice del Centro Huffington sull'Invecchiamento, che è anche coautrice senior dello studio. Roy ha scoperto che quasi tutti i cervelli degli animali in questi modelli avevano placche contenenti acidi nucleici. “La composizione di queste placche non era stata ben caratterizzata prima”, ha detto Roy.
L'IFN apre la strada alla perdita di sinapsi
È interessante notare che, Cao, Roy ed i loro colleghi hanno scoperto che gli stessi cervelli dei topi che avevano placche amiloidi con acidi nucleici mostravano anche una firma molecolare che mimava una risposta antivirale dell'IFN.
Ulteriori esperimenti hanno rivelato che gli acidi nucleici nelle placche attivano le microglia del cervello, che producono IFN, che a sua volta innesca una cascata di reazioni infiammatorie che portano alla perdita di sinapsi, le giunzioni attraverso cui comunicano i neuroni. La perdita di sinapsi è una parte fondamentale della neurodegenerazione e può portare alla perdita di memoria e, infine, alla demenza.
Sappiamo bene che la perdita di sinapsi è mediata direttamente dal sistema di complemento, che fa parte del sistema immunitario. Esso comprende un gruppo di proteine che funzionano insieme per eliminare microbi e cellule danneggiate, ma è anche coinvolto nel processo infiammatorio.
“Anche se sapevamo che l'attivazione del complemento innesca la perdita di sinapsi, quello che abbiamo scoperto è la catena di eventi che portano a questo risultato. La catena di eventi punta ai percorsi mediati dall'IFN, che comandano l'attivazione del complemento“, ha detto la Cao.
"Siamo entusiasti di ever scoperto che bloccare la cascata di reazioni innescata dall'IFN attenua significativamente l'attivazione delle microglia e riduce la perdita di sinapsi nei nostri topi modello, confermando ulteriormente il ruolo principale dell'IFN in questo processo“, ha detto Roy.
Questo studio è un progresso importante per capire un meccanismo che porta al danno neuronale, collegando IFN, complemento e perdita di sinapsi: l'IFN controlla l'espressione di molteplici componenti della cascata del complemento e media l'eliminazione delle sinapsi in modo dipendente dal complemento.
Collegamento con l'uomo
I ricercatori hanno esaminato il cervello umano con MA per vedere se sono presenti caratteristiche simili a quelle che avevano osservato nei topi modello della condizione: “Abbiamo scoperto che il cervello umano con MA ha una profonda attivazione del percorso IFN, suggerendo che nella distruzione dei neuroni delle persone con la malattia, possono essere coinvolti meccanismi simili a quelli che abbiamo trovato nei topi”, ha detto Roy. “Devono essere condotti ulteriori studi per valutare questa ipotesi”.
Questo è importante perché, se confermato, porterebbe ad una migliore comprensione di come nasce il MA e suggerire nuove terapie per questa malattia incurabile.
Sappiamo che l'accumulo di placche amiloidi nel cervello umano si correla male con la gravità o la durata della demenza. Ci sono persone senza segni di demenza che hanno quantità significative di placche amiloidi e grovigli di tau nel cervello, ma mancano di una attivazione robusta delle microglia e della risposta infiammatoria che è associata alla perdita di sinapsi e neuroni.
D'altra parte, il cervello delle persone con demenza da MA presenta placche amiloidi, grovigli di tau e infiammazione che sono coinvolti nella neurodegenerazione.
"I nostri risultati nei topi modello suggeriscono che è plausibile che le placche che si accumulano nei pazienti con MA e quelle degli individui senza demenza si differenziano per il loro contenuto di acidi nucleici. È quindi di grande interesse esaminare più da vicino i costituenti molecolari delle placche amiloidi nel cervello di individui cognitivamente resilienti e confrontarli con quelli dei casi di MA“, ha detto la Cao.
Questo lavoro può anche fornire nuove intuizioni sull'invecchiamento cerebrale. Altri lavori hanno dimostrato che l'IFN sembra partecipare anche al normale processo di invecchiamento del cervello. Cao, Roy ed i loro colleghi pensano che valga anche la pena esplorare ulteriormente la possibilità di modulare l'attività dell'IFN nelle popolazioni che invecchiano.
Fonte: Baylor College of Medicine (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Ethan Roy, Baiping Wang, Ying-Wooi Wan, Gabriel Chiu, Allysa Cole, Zhuoran Yin, Nicholas Propson, Yin Xu, Joanna Jankowsky, Zhandong Liu, Virginia M.Y. Lee, John Trojanowski, Stephen Ginsberg, Oleg Butovsky, Hui Zheng, Wei Cao. Type I interferon response drives neuroinflammation and synapse loss in Alzheimer disease. J Clin Invest., 9 Jan 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV