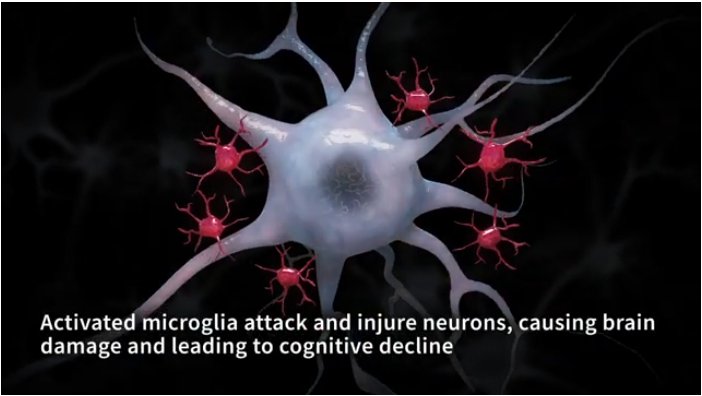
Il morbo di Alzheimer (MA) è la forma più comune di demenza ed è caratterizzata dall'accumulo di placche di amiloide nel cervello. Le microglia, le sentinelle immunitarie del cervello, non sono solo responsabili dell'eliminazione degli invasori stranieri, ma anche del mantenimento dell'omeostasi del cervello, eliminando i rifiuti tossici come le placche amiloidi.
Tuttavia, il ruolo delle microglia nel MA e la loro relazione con l'accumulo di placca amiloide era finora poco chiara. Ora, un team di scienziati della Duke-NUS (USA-Singapore) e della Monash University (Australia) ha trovato le firme di espressione genica alla base delle microglia associate alla fagocitosi della placca amiloide, cioè l'inghiottimento dei depositi di proteina amiloide-beta (Aβ) nel cervello.
I risultati, riferiti su Nature Communications, offrono un nuovo obiettivo per interventi che mirano ad affrontare il meccanismo sottostante questa malattia incurabile.
Per indagare sulle differenze tra cervelli sani e quelli dei pazienti con MA a risoluzione di singola cellula, il team di scienziati della Duke-NUS e della Monash ha intrapreso un progetto ambizioso per studiare in modo completo i cambiamenti di espressione genica in tipi specifici di cellule cerebrali umane associati alla progressione del MA. Dal momento di quello studio, pubblicato su Nature Neuroscience nel 2019, la squadra si è concentrata sulle microglia.
"Abbiamo cercato di capire i meccanismi molecolari e le differenze tra le microglia che stavano inghiottendo attivamente le placche amiloidi nel MA e quelle che non lo facevano", ha detto il prof. associato Enrico Petretto del Programma Disturbi Cardiovascolari e Metabolici della Duke-NUS, e coautore senior dello studio.
La squadra ha usato un colorante, chiamato Methoxy-XO4, che punta specificamente le microglia che hanno inghiottito le placche amiloidi. Dopo aver applicato il colorante a modelli preclinici del MA, ha poi esaminato l'espressione genetica nelle microglia macchiate. Ha studiato le differenze nell'espressione genica alla base della capacità delle microglia di ingerire particelle (ad esempio placca amiloide) e identificato le molecole regolatorie associate.
"Comprendere questo meccanismo è importante perché ora abbiamo diversi nuovi bersagli da seguire, e in futuro, questi obiettivi possono aprire un nuovo fronte contro questa malattia devastante", ha affermato il professor Jose M. Polo del Monash Biomedicine Discovery Institute, coautore senior dello studio.
L'esame ha rivelato che i modelli di espressione genica delle microglia che non hanno assorbito amiloide sono simili a quelli delle microglia invecchiate, che sono note per essere disfunzionali e un protagonista della patogenesi del MA. Inoltre, dopo che le microglia hanno inghiottito le placche amiloidi associate al MA, sviluppano un modello caratteristico di espressione genica (la firma).
Questo cambiamento nell'espressione genica è indotto, in parte, da un gene chiamato Hif1a. L'espressione genica modificata aumenta la capacità delle microglia di assorbire proteine come l'amiloide, mentre ridurre l'Hif1a produce il risultato contrario, evidenziando l'importanza dell'Hif1a nel controllare questa funzione delle microglia. Questo ruolo regolatorio dell'Hif1a potrebbe anche valere per la funzione microgliale di rimozione delle sinapsi danneggiate.
"È possibile che questo processo sia inizialmente protettivo", ha detto Petretto, "quando le microglia potano efficacemente le sinapsi danneggiate situate vicino alle placche". Gli scienziati sospettano, tuttavia, che questo processo di potatura in seguito si deteriori, mentre la malattia progredisce.
Il team ha anche usato modelli computazionali per prevedere le reti di molecole coinvolte nell'assorbimento delle proteine da parte delle microglia, e ha identificato i potenziali obiettivi di studio per lo sviluppo di un farmaco. Ad esempio la rapamicina, un immunosoppressore ampiamente usato, ha dimostrato di impedire al gene Hif1a di indurre le microglia a inghiottire le placche amiloidi.
"Questa relazione tra Hif1a e il declino cognitivo nel MA deve ancora essere svelato in modo completo", ha detto il dottorando Gabriel Chew, che è un primo coautore dello studio. "Il lavoro futuro potrebbe concentrarsi sull'uso dello strumento di modifica genetica CRISPR per testare l'impatto della manipolazione dell'Hif1a sulla gravità dei sintomi e sulla progressione della malattia".
Fonte: Duke-National University of Singapore (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Alexandra Grubman, Xin Yi Choo, Gabriel Chew, John Ouyang, Guizhi Sun, Nathan Croft, Fernando Rossello, Rebecca Simmons, Sam Buckberry, Dulce Vargas Landin, Jahnvi Pflueger, Teresa Vandekolk, Zehra Abay, Yichen Zhou, Xiaodong Liu, Joseph Chen,M ichael Larcombe, John Haynes, Catriona McLean, Sarah Williams, Siew Yeen Chai, Trevor Wilson, Ryan Lister, Colin Pouton, Anthony Purcell, Owen Rackham, Enrico Petretto, Jose Polo. Transcriptional signature in microglia associated with Aβ plaque phagocytosis. Nature Communications, 21 May 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV