Ricercatori dell'Università Vanderbilt segnalano nel numero del 1 giugno della rivista Science che la struttura molecolare di una proteina coinvolta nell'Alzheimer - e la sorprendente scoperta che si lega al colesterolo - potrebbe portare a nuove terapie per la malattia.
Charles Sanders, Ph.D., professore di Biochimica e i colleghi del Centro di Biologia Strutturale, hanno definito la struttura di una parte della proteina precursore dell'amiloide (APP), la fonte della beta-amiloide, ritenuta l'innesco dell'Alzheimer.
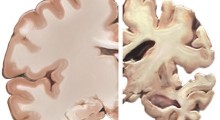
La beta-amiloide si raggruppa in oligomeri che uccidono i neuroni, causando la demenza e la perdita di memoria. Gli oligomeri di beta-amiloide infine formano le placche nel cervello, uno dei tratti distintivi della malattia. "Qualsiasi cosa che riduce la produzione di beta-amiloide dovrebbe contribuire a prevenire, o eventualmente a trattare l'Alzheimer", ha affermato Sanders.
La produzione di beta-amiloide richiede due "tagli" della proteina APP. Il primo taglio, da parte dell'enzima beta-secretasi, genera la proteina C99, che viene poi tagliata dalla gamma-secretasi rilasciando beta-amiloide. I ricercatori della Vanderbilt hanno utilizzato la risonanza magnetica nucleare e la spettroscopia di risonanza elettronica paragmagnetic per determinare la struttura del C99, che ha una membrana che copre l'area.
Sono stati sorpresi di scoprire quello che sembrava essere un dominio "vincolante" della proteina. Sulla base delle prove precedentemente riportate, che il colesterolo promuove l'Alzheimer, sospettavano che il colesterolo avrebbe potuto essere il partner di legame. I ricercatori hanno utilizzato un sistema modellato a membrana chiamato "bicelle" (sviluppato da Sanders quand'era borsista post-dottorato) per dimostrare che il C99 si lega al colesterolo.
"Si pensava da tempo che il colesterolo promuova in qualche modo l'Alzheimer, ma i meccanismi non erano chiari", ha affermato Sanders. "Il legame del colesterolo all'APP e il suo frammento C99 è probabilmente uno dei modi che rende più probabile la malattia". Sanders e il suo team propongono che il colesterolo vincolante muove l'APP verso specifiche regioni della membrana cellulare, chiamate "zattere lipidiche", che contengono "cricche di molecole che amano stare insieme", ha detto.
Le secretasi beta e gamma fanno parte della cricca della zattera lipidica. "Pensiamo che quando l'APP non ha il colesterolo intorno, non importa in quale parte della membrana è", ha affermato Sanders. "Ma quando lega il colesterolo, questo la spinge verso le zattere lipidiche, dove queste secretasi 'cattive' sono in attesa di agganciarla e produrre beta-amiloide".
I risultati suggeriscono una nuova strategia terapeutica per ridurre la produzione di beta-amiloide, ha detto. "Se si potesse sviluppare un farmaco che impedisce al colesterolo di legarsi all'APP, allora si ferma la proteina prima che vada alle zattere lipidiche. Al contrario sarebbe scissa dall'alfa-secretasi, una secretasi 'buona' che non è nelle zattere e non genera beta-amiloide". I farmaci che inibiscono le secretasi beta o gamma (per limitare direttamente la produzione di beta-amiloide) sono stati sviluppati e testati, ma hanno effetti collaterali tossici. Un farmaco che impedisca al colesterolo di legare l'APP può essere più preciso ed efficace nel ridurre i livelli di beta-amiloide e nella prevenzione, o trattamento dell'Alzheimer.
[...]
***********************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
***********************
Fonte: Materiale del Vanderbilt University Medical Center, via Newswise.
Riferimento: PJ Barrett, Y. Song, WD Van Horn, EJ Hustedt, JM Schafer, A. Hadziselimovic, AJ Beel, CR Sanders. The Amyloid Precursor Protein Has a Flexible Transmembrane Domain and Binds Cholesterol. Science, 2012; 336 (6085): 1168 DOI: 10.1126/science.1219988.
Pubblicato in ScienceDaily il 31 Maggio 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |







 Associazione Alzheimer OdV
Associazione Alzheimer OdV